
| A. | Zn-→Zn2+ | B. | H+-→H2 | C. | MnO2-→Mn2+ | D. | Cl2-→Cl- |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
在NaCl和NaBr的混合溶液中,Na+、Br-、Cl-的物质的量浓度之比不可能出现的是
A.5:3:2 B.3:2:2 C.5:4:1 D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
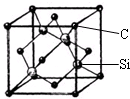 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
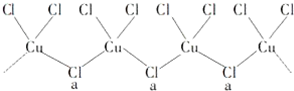
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
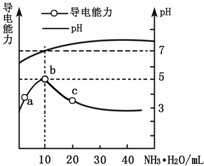 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | b点溶液pH=5,此时酸碱恰好中和 | |
| B. | a~b点导电能力增强,说明HR为弱酸 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| B. | 一种金属元素可能有多种氧化物,同一金属同一价态也可能有多种氧化物 | |
| C. | 金属钠、镁等金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 工业上可用铝热反应大规模炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | A、B、C三种物质的浓度不随时间变化而变化 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com