
分析 由热化学方程式可知,1molSO2与O2混合后充分反应,放出98.30kJ热量,则当放出314.56kJ热量时,消耗的SO2为1mol×$\frac{314.56kJ}{98.30kJ}$=3.2mol,以此计算.
解答 解:由热化学方程式可知,1molSO2与O2混合后充分反应,放出98.30kJ热量,则当4molSO2与一定量O2混合后充分反应,放出314.56kJ热量时,消耗的SO2为1mol×$\frac{314.56kJ}{98.30kJ}$=3.2mol,SO2的转化率为$\frac{3.2mol}{4mol}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡的计算,为高频考点,把握物质的量与热量的关系、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意热化学方程式的意义,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
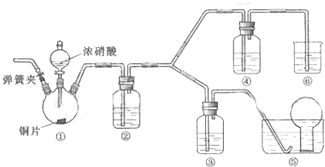
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
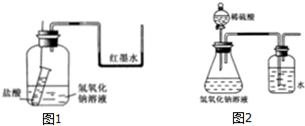
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
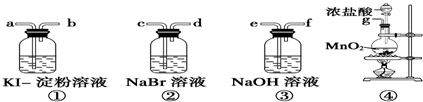
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com