
���� ��1�����ݷ�Ӧ���ʱ�������ʱ�С��0 ��Ӧ���ȣ��ʱ����0��Ӧ�����ȷ�Ӧ��
��2�������Ȼ�ѧ����ʽ�ۼ���õ���
��3�������Ȼ�ѧ����ʽ�ٵĶ�����ϵ���㣻
��4����1g̼������ˮ������Ӧ����CO��H2��������10.94kJ��������1mol̼��ˮ������Ӧ������10.94KJ��12=131.28kJ����ע�����ʵ�״̬�����
��� �⣺��1����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol���ʱ�С��0����Ӧ�Ƿ��ȷ�Ӧ��
��2H2��g��+SO2��g��?S��g��+2H2O��g����H=90.4kJ/mol���ʱ����0����Ӧ�����ȷ�Ӧ��
��2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ/mol���ʱ�С��0����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ���٢ۣ��ڣ�
��2��2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ/mol��
4g H2��g�� ��ȫ��Ӧ���ɼ״�����ʱ����90.8kJ��
�ʴ�Ϊ��-90.8��
��3��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol
����1mol NH3 ��g�� �ķ�Ӧ��Ϊ-46.2KJ/mol��
�ʴ�Ϊ��-46.2��
��4����1g̼������ˮ������Ӧ����CO��H2��������10.94kJ��������1mol̼��ˮ������Ӧ������10.94KJ��12=131.28kJ��
��˷�Ӧ���Ȼ�ѧ����ʽΪC��s��+H2O��g���TCO��g��+H2��g����H=+131.28kJ•mol-1��
�ʴ�Ϊ��C��s��+H2O��g���TCO��g��+H2��g����H=+131.28kJ•mol-1��
���� ���⿼�����Ȼ�ѧ����ʽ����д�����ͼ���Ӧ�ã�ע���ʱ��жϷ�Ӧ�����ı仯����Ŀ�ϼ�


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
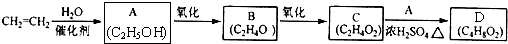
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3��CO2 | B�� | HClO��O2 | C�� | HCl��Ũ����MnCl2 | D�� | NaBr��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ԭ������������ | B�� | ��������Ų��������Ա仯 | ||
| C�� | Ԫ�صĻ��ϼ۳������Ա仯 | D�� | �˵���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ�ô����ɼӿ�SO2ת��ΪSO3������ | |
| B�� | H2��I2��HIƽ��������ѹ����ɫ���� | |
| C�� | װ��NO2��N2O4ƽ�������IJ���������ˮ��������ɫ��dz | |
| D�� | SO2ͨ����ˮ����ˮ����ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ҫ���Ȳ��ܷ����ķ�Ӧ���������ȷ�ӦҲ�����Ƿ��ȷ�Ӧ | |
| B�� | 1 molǿ����1molǿ����кͷ�Ӧ���ų������������к��� | |
| C�� | ���ε�س��ʱ������ת��Ϊ��ѧ�� | |
| D�� | �����������ɷ���״����������ߴ�Ч�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���м����������̼���κͼ����������ڶ����壩��һ�ֲ�����̼������ɵĻ���ȡ��7.560g�����������ȫ��Ӧ���ų�CO2���Ϊ1.344L������£���ȡ��������ԭ������ˮ���裬���˳���������1.420g��
���м����������̼���κͼ����������ڶ����壩��һ�ֲ�����̼������ɵĻ���ȡ��7.560g�����������ȫ��Ӧ���ų�CO2���Ϊ1.344L������£���ȡ��������ԭ������ˮ���裬���˳���������1.420g���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com