
【题目】已知4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系是
A.4υ(NH3)=5υ(O2)B.5υ(O2)=6υ(H2O)
C.2υ(NH3)=3υ(H2O)D.4υ(O2)=5υ(NO)
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途说法不正确的是
A.碳酸氢钠可被用于治疗胃酸过多B.Cl2可被用于工业制漂粉精
C.明矾可用于自来水的杀菌消毒D.Fe2O3俗称铁红,常用作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计如图装置。请回答下列问题:
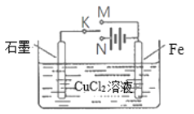
(1)若K与M、N均断开,发生的离子反应为____________________。
(2)若K与M相连、与N断开,石墨为_________(填电极名称)。
(3)若K与N相连、与M断开,石墨电极处的现象为____________________。
(4)若将CuCl2溶液换成精制饱和食盐水,仍保持K与N相连、与M断开,此时装置中发生的离子反应方程式为_______________________________。若此反应过程中转移1mol电子,理论上共产生标准状况下气体__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列选项所示物质间转化均能一步实现的是( )
A.Cl2→HCl→NaClOB.Al→NaAlO2→Al(OH)3
C.Cu→CuO→Cu(OH)2D.Fe→Fe(OH)3→FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
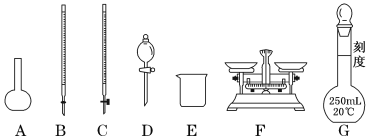
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
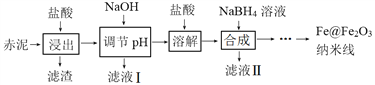
回答下列问题:
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
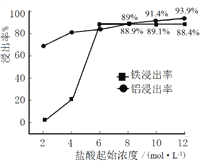
①盐酸的合适浓度为______________。
②盐酸起始浓度为2 mol·L﹣1时,铁的浸出率很低,原因是______________。
(2)已知:25℃时,Al(OH)3(s)![]() AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
(3)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液Ⅱ中含B(OH)3,合成铁核的离子方程式为____________________________。
②“合成”后,经过滤、______________、______________获得Fe@Fe2O3纳米线。
(4)Fe@Fe2O3纳米线去除水体中Cr2O72-的机理是,纳米线将Cr2O72-吸附在表面并还原。在“无氧”和“有氧”条件下将纳米线分别置于两份相同的水体中,80 min后回收该纳米线,测得其表面元素的原子个数比如下表:

①在水体中Fe@Fe2O3纳米线形成的分散系是____________________________。
②样本2的实验条件是______________(填“有氧”或“无氧”)。
③已知水体中检测不到Cr(Ⅲ),样本1中Fe@Fe2O3纳米线的表面Cr(Ⅵ)的去除率为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com