
| A. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 | |
| B. | 试管、烧杯、烧瓶、蒸发皿、量筒都可以直接在火焰上加热 | |
| C. | 可燃性气体点燃前必须验纯 | |
| D. | 制备蒸馏水时,弃去开始馏出的部分液体 |
分析 A.稀释浓硫酸时需要将浓硫酸缓缓加入水中,顺序不能颠倒;
B.量筒是不能加热的仪器;
C.可燃性气体若纯度不足,点燃时易发生爆炸;
D.开始馏出的部分液体中含有沸点较低的杂质.
解答 解:A.浓硫酸密度较大,且稀释时会放出大量的热,稀释浓硫酸时先将水放进烧杯里,然后将浓硫酸沿烧杯壁倒入,并用玻璃棒不停得搅拌,故A正确;
B.试管、烧杯、烧瓶、蒸发皿都可以直接在火焰上加热,但量筒不能加热,故B错误;
C.为了避免发生爆炸,可燃性气体点燃前必须验纯,故C正确;
D.制备蒸馏水时,为了除去水中沸点较低的杂质,需要先弃去开始馏出的部分液体,故D正确;
故选B.
点评 本题考查化学实验方案的评价,题目难度不大,涉及浓硫酸稀释、常见仪器的使用方法、气体验纯、蒸馏等知识,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的化学实验能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
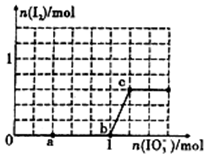 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0-a段发生反应:3 HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b段共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c段反应:氧化产物为I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:1时,加入的KIO3为1.lmol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
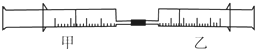 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 10mL HCl | 10mL NH3 |
| 2 | 30mL NO2 | 10mL H2O(液) |
| 3 | 20mL HBr | 10mL Cl2 |
| 4 | 10mL CCl4 | 10mL NH3 |
| A. | 上述4个实验均发生了氧化还原反应 | |
| B. | 实验2,甲针筒内最终的无色气体是NO | |
| C. | 实验3,甲针筒内充满黄绿色气体 | |
| D. | 实验4,甲针筒内活塞将向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向NaAlO2溶液中滴入NaHCO3溶液 | 有白色沉淀生成 | AlO2-结合H+的能力比CO32-强 |
| B | 向某溶液中滴入氯水,再滴加KSCN溶液 | 溶液显血红色 | 原溶液中一定有Fe2+ |
| C | 向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| D | 用洁净的铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 原溶液中一定有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液、CCl4、BaCl2溶液 | B. | Na2SO3溶液、FeCl3溶液、H2S溶液 | ||
| C. | SO2气体、KOH溶液、镁粉 | D. | NaOH溶液、CO气体、石蕊溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C 元素的相对分子质量是 12,则 1mol C 的质量为 12g/mol | |
| B. | 1mol Cl2 的体积为 22.4L | |
| C. | 1mol CO2 中含有 3 个原子 | |
| D. | 已知 NaOH 溶液的物质的量浓度为 0.5mol/L,则 2L 该溶液中含 NaOH 1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com