
 CH3OH(g) ��H1
CH3OH(g) ��H1 CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
 a�����������ʵ�Ũ�ȱ��ֲ��䣻 b��������ѹǿ���ֲ��䣻
a�����������ʵ�Ũ�ȱ��ֲ��䣻 b��������ѹǿ���ֲ��䣻 c����(CO)����==1/2��(H2)���ɡ� d �������ڵ��ܶȱ��ֲ���
c����(CO)����==1/2��(H2)���ɡ� d �������ڵ��ܶȱ��ֲ���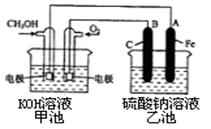
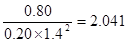 �������¶���250�档
�������¶���250�档

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д� ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
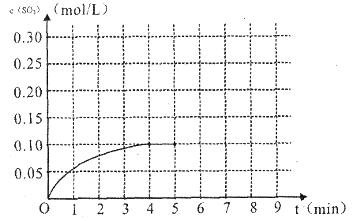
 2SO3��g���ﵽƽ��״̬��
2SO3��g���ﵽƽ��״̬��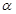 ������ϵ��ѹǿ��P���Ĺ�ϵ����ͼ1��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��__________K��B�����>������<����=������
������ϵ��ѹǿ��P���Ĺ�ϵ����ͼ1��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��__________K��B�����>������<����=������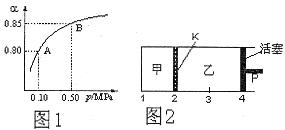
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
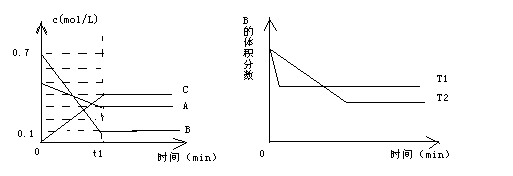
 N2 + 3H2����ij�¶��µ�ƽ�ⳣ��Ϊ0.25����ô���ڴ������£����ĺϳɷ�Ӧ1/2 N2 + 3/2 H2
N2 + 3H2����ij�¶��µ�ƽ�ⳣ��Ϊ0.25����ô���ڴ������£����ĺϳɷ�Ӧ1/2 N2 + 3/2 H2 NH3��ƽ�ⳣ��Ϊ
NH3��ƽ�ⳣ��Ϊ| A��4 | B��2 �� | C��1 | D��0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��
�� ��������Ӧ
��������Ӧ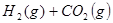
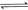
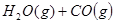 ������ʼŨ�����±���ʾ�����ƽ��ʱ����
������ʼŨ�����±���ʾ�����ƽ��ʱ����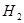 ��ת������60%�������ж���ȷ����
��ת������60%�������ж���ȷ����| ��ʼŨ�� | �� | �� | �� |
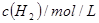 | 0.010 | 0.020 | 0.020 |
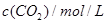 | 0.010 | 0.010 | 0.020 |
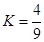
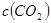 �Ǽ��е�2��
�Ǽ��е�2�� ��ת���ʾ���60%
��ת���ʾ���60%�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ȼ�����Һ�м���һ������Ũ���ᣬ��Һ��ɫ�ı仯���ɷۺ�ɫ��Ϊ��ɫ |
B����֪I3�� I2 + I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2 + I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
| C���ڡ���п��Ƥ�ĶƲ��ȵIJⶨ��ʵ���У�����п��Ƥ����ϡ���ᣬ����������������ͻȻ��С�������ж�п�Ʋ��ѷ�Ӧ��ȫ |
| D���궨NaOH��Һ�Ļ����ʿ��ò��ᡢ�����ᡢ�ڱ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO��g����3H2��g������H����206 kJ/mol��һ�������������Ϊ1 L���ܱ������г���1 mol CH4��1 mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���� �� ��
CO��g����3H2��g������H����206 kJ/mol��һ�������������Ϊ1 L���ܱ������г���1 mol CH4��1 mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���� �� ��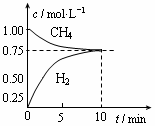
| A��10minʱ��CH4��ʾ�ķ�Ӧ����Ϊ0.075 mol?L��1?min��1 |
| B��ʹ�ø�Ч�����ܹ�����CO�IJ��� |
| C���������·�Ӧ��ƽ�ⳣ��Ϊ0.1875 |
D�������¶���ʹ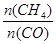 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3��״̬��ʱ��ƽ�⣬��O2��ת����Ϊ�� ��
2SO3��״̬��ʱ��ƽ�⣬��O2��ת����Ϊ�� ��
| A��40�� | B��60�� | C��80�� | D��90�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB(g)�ﵽ��ѧƽ��ı�־��
2AB(g)�ﵽ��ѧƽ��ı�־���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com