
| A. | 硼和硅 | B. | 铝和铁 | C. | 碳和铝 | D. | 铜和金 |
科目:高中化学 来源: 题型:选择题
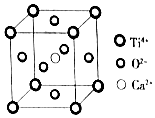
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 该晶体中每个Ti4+和8个O2-相紧邻 | |
| C. | 一个CO2晶胞中平均含有4个CO2分子 | |
| D. | 金属晶体的熔点可能比分子晶体的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
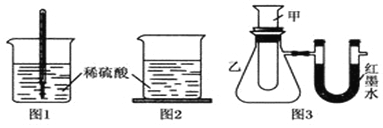
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+ )•c(OH- )=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
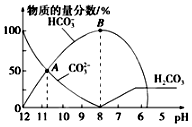 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
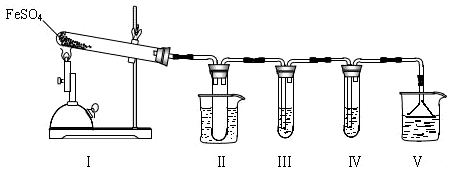
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
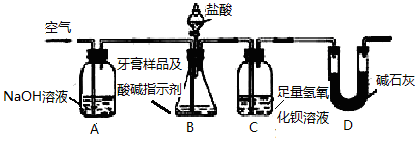
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 3.0 g 甲醛和乙酸的混合物中含有的原子总数为0.6NA | |
| D. | 0.1 mol C2H6O分子中含有C-H键数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com