
H2SO3+I2+H2O══H2SO4+2HI 2FeCl3+2HI══2FeCl2+2HCl+I2
3FeCl2+4HNO3══2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
科目:高中化学 来源: 题型:
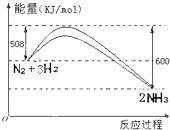 根据要求回答下列叙述相关问题
根据要求回答下列叙述相关问题| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 温度 |
活性炭(mol) | NO(mol) | E(mol) | F(mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、增大压强;平衡状态II不移动 |
| C、升高温度平衡状态Ⅲ向正反应方向移动 |
| D、反应Ⅱ,Ⅲ均为放热反应 |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第7期 总第163期 人教课标版 题型:022
铜有+1价和+2价,铜及其合金在日常生活中应用广泛.根据下列信息回答相关问题.
(1)工业冶炼铜的原理主要是:
(Ⅰ)2Cu2S(硫化亚铜)+3O2![]() 2Cu2O+2SO2
2Cu2O+2SO2
(Ⅱ)2Cu2O(氧化亚铜)+Cu2S![]() 6Cu+SO2↑.
6Cu+SO2↑.
①关于氧化亚铜、硫化亚铜的判断,正确的是

②如果反应(Ⅰ)和反应(Ⅱ)产生的二氧化硫质量相等,则转移的电子数之比为________
A.1∶1
B.2∶1
C.1∶2
D.3∶1
(2)西汉刘安在《淮南万毕术》中介绍了我国在西汉时期发明了湿法冶金技术,即“曾青得铁化为铜”,其含义是铜的可溶性化合物的水溶液与铁反应生成铜.例如,硫酸铜溶液与铁反应:CuSO4+Fe![]() Cu+FeSO4.下列有关该反应的判断:①属于置换反应;②铁被氧化;③铜是氧化产物;④氧化性:FeSO4>CuSO4;⑤还原性:Fe>Cu.其中不正确的是________.
Cu+FeSO4.下列有关该反应的判断:①属于置换反应;②铁被氧化;③铜是氧化产物;④氧化性:FeSO4>CuSO4;⑤还原性:Fe>Cu.其中不正确的是________.
A.①⑤
B.②③
C.③④
D.②⑤
(3)现代冶铜可以利用热还原法,如H2+CuO![]() Cu+H2O,2Al+3CuO
Cu+H2O,2Al+3CuO![]() 3Cu+Al2O3,CO+CuO
3Cu+Al2O3,CO+CuO![]() Cu+CO2.若制取等质量的还原产物,参加反应的还原剂H2、Al、CO的质量比为________.
Cu+CO2.若制取等质量的还原产物,参加反应的还原剂H2、Al、CO的质量比为________.
A.1∶1∶1
B.1∶3∶1
C.1∶9∶14
D.3∶2∶3
(4)铜器保存不善,在潮湿的空气中会生铜锈,主要的化学反应为2Cu+CO2+O2+H2O![]() Cu2(OH)2CO3(铜绿),该反应属于化合反应,判断的依据是________;该反应是氧化还原反应,判断的依据是________;氧化产物是________,还原产物是________,判断的依据分别是________.
Cu2(OH)2CO3(铜绿),该反应属于化合反应,判断的依据是________;该反应是氧化还原反应,判断的依据是________;氧化产物是________,还原产物是________,判断的依据分别是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com