

 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。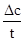 ,,降解率=
,,降解率= ×100%来计算;
×100%来计算; ×100%来计算;
×100%来计算; Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=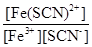 来计算。
来计算。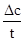 =
= =
=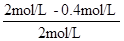 ×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%; Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=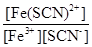 =
=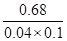 =170L/mol。
=170L/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是| A.用物质A表示的反应速率为0.6mol/(L·s) |
| B.用物质B表示的反应速率为0.3mol/(L·s) |
| C.2s时物质B的浓度为0.3mol/L |
| D.2s时物质A的转化率为30% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
| A.第6min后,反应就终止了 |
| B.若降低温度,v正和v逆将以同样倍数减小 |
| C.X的平衡分解率为85% |
| D.若升高温度,.X的平衡分解率为85% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )
C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )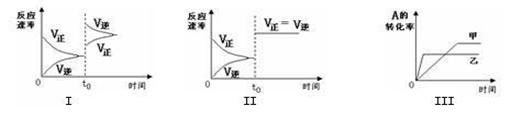
| A.图I可体现t0时升高温度对反应速率的影响 |
| B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图III可体现温度对化学平衡的影响,且乙的温度较高 |
| D.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 鸡没有汗腺,在夏天只能依赖喘息调节体温。鸡过度呼出CO2,会使下列平衡向左移动,导致蛋壳变薄,使农场主和超市蒙受经济损失。
鸡没有汗腺,在夏天只能依赖喘息调节体温。鸡过度呼出CO2,会使下列平衡向左移动,导致蛋壳变薄,使农场主和超市蒙受经济损失。 CO2(g) CO2(l)
CO2(g) CO2(l) (aq)+
(aq)+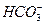 (aq)
(aq) 
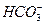 (aq)
(aq) H+(aq)+
H+(aq)+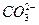 (aq)
(aq)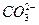 (aq)
(aq) CaCO3(s)
CaCO3(s)| A.淡盐水 | B.碳酸水 | C.蔗糖水 | D.澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.p(N2)>p(H2)>p(HCl) | B.p(HCl)> p(N2)> p(H2) |
| C.p(H2)> p(HCl)> p(N2) | D.p(H2)> p(N2)> p(HCl) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下: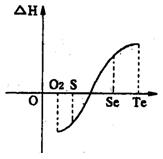
 _____
_____ _____.
_____.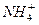 +
+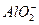 +2H2O
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
Al(OH)3↓ +NH3·H2O,向含有等物质的量的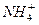 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中: 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示: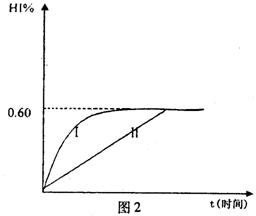
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com