
分析 (1)过量的O2可以提高SO2的转化率,采用这样比值增大O2的浓度,提高了SO2的转化率;
(2)依据铵盐的不稳定性,结合题意:有利于(NH4)2S04的生成;
(3)空气中氧气与氢气混合高温反应会发生爆炸;
(4)SO2催化氧化为SO3,是可逆反应,不能完全反应,催化剂只能改变反应速率,不能改变化学平衡;
(5)根据二氧化硫与氨气反应的关系,可以求得所需的氨气的量,再求得利用率;
(6)减小酸雨就是减小二氧化硫的排放,也就要减少含硫的燃料的使用,所以要开发洁净的能源,据此答题.
解答 解:(1)过量的O2可以提高SO2的转化率,采用这样比值增大O2的浓度,提高了SO2的转化率,有利于平衡向生成三氧化硫的方向移动;
故答案为:增加氧气的浓度,提高二氧化硫转化率,有利于平衡向生成三氧化硫的方向移动;
(2)依据题意可知,低温有利于生成硫酸铵,且硫酸铵为铵盐,具有不稳定性,受热易分解;
故答案为:(NH4)2S04在温度高时会分解并且有利于(NH4)2S04的生成;
(3)合成氨时,原料N2不能用空气代替,主要原因是在高温下,空气中的氧气与氢气混合会爆炸;
故答案为:在高温下,空气中的氧气与氢气混合会爆炸;
(4)催化剂缩短到达平衡时间,不影响平衡移动,所以二氧化硫的转化率不变,性能优越的催化剂,不可能将SO2全部催化氧化为SO3,
故答案为:不可信;二氧化硫与氧气的反应是可逆反应,使用催化剂只能改变反应速率,不能使平衡移动,更不能全部转化;
(5)此题涉及的反应有:2SO2+O2?2SO3…①,2NH3+SO3+H2O=(NH4)2SO4…②,①、②两式联立,可得SO2~SO3~2NH3~(NH4)2SO4可知废气中SO2与NH3按1:2通入,而废气3m3/h的速率通过V2O5触媒层,含有的二氧化硫的体积为3×0.3%m3=9L/h,所以每小时需要氨气的体积为18L,故氨气的利用率为$\frac{18}{25}$×100%=72%,
故答案为:18;72%;
(6)减小酸雨就是减小二氧化硫的排放,也就要减少含硫的燃料的使用,所以要开发洁净的能源,太阳能就是其中之一,故选BC.
点评 本题考查了工业制(NH4)2SO4的基本原理,侧重考查了化学平衡的影响因素,注意工业制备选择条件的分析方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤族元素单质X2(X代表F、Cl、Br、I)均可以与水反应生成HX | |
| B. | 高纯度的硅单质用于制作光导纤维 | |
| C. | 将SO2通入次氯酸钙溶液可得到次氯酸 | |
| D. | 氢氧化铁溶于氢碘酸的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2和3 | B. | 3和2 | C. | 3和1 | D. | 1和3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH饱和溶液,又有CaCO3沉淀生成 | |
| B. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| C. | 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积前者多 | |
| D. | 向Na2CO3饱和溶液中通CO2,有NaHCO3结晶析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
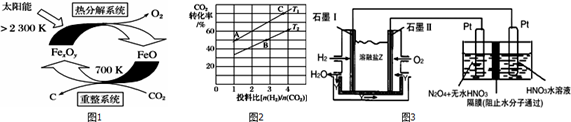
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
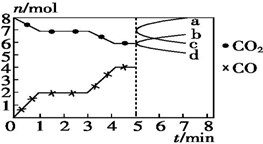 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )| A. | 0~1 min,v(CO)=1 mol•L-1•min-1;1~3 min,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,反应一定达到平衡状态,$\frac{P(平衡)}{P(起始)}$<1 | |
| C. | 3 min时,温度由T1升高到T2,则Q>0,再达平衡时,$\frac{K({T}_{2})}{K({T}_{1})}$>1 | |
| D. | 5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com