
| A. | 钠在空气中充分燃烧时先熔化再燃烧,最后所得的产物只有Na2O2 | |
| B. | 金属钠不能保存在密闭容器中,应保存在煤油中 | |
| C. | 铝制品在生活中非常普遍,是因为铝的化学性质不活泼 | |
| D. | 铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 |
分析 A.钠的熔点较低,钠在空气中燃烧生成过氧化钠;
B.钠极易被氧化,所以保存在煤油中;
C.铝很活泼,极易和氧气反应生成氧化铝;
D.铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属.
解答 解:A.钠的熔点较低,所以在空气燃烧时先熔化,再燃烧,燃烧时生成淡黄色的Na2O2,故A正确;
B.因为钠易与空气中的水、氧气反应,为了隔绝空气,通常将钠保存在煤油中,故B正确;
C.铝是活泼金属,极易和氧气反应生成致密的氧化物薄膜,故C错误;
D.铁在潮湿的空气中容易生锈,铁锈是一种疏松多孔的物质,所以不能保护内层金属,故D正确;
故选C.
点评 本题考查金属的性质,明确铝在空气中不需要特殊保护的原因,难度不大.


科目:高中化学 来源: 题型:多选题
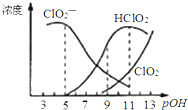 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+═2 H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于2 | B. | 在3~4之间 | C. | 等于3 | D. | 在2~3之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b | |
| D. | 已知P(红磷,s)═p(白磷,s)△H>0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com