
| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 新戊烷 |
分析 烷烃既能由烯烃加氢得到也能由炔烃加氢得到,则烷烃中相邻2个C上各存在2个H,以此来解答.
解答 解:A.2-甲基丙烷为CH3CH(CH3)CH3,不能由炔烃加成得到,故A不选;
B.2-甲基丁烷为CH3CH(CH3)CH2CH3,最后的2个C可由烯烃、炔烃加成得到,故B选;
C.2,2-二甲基丙烷为C(CH3)4,不能由烯烃、炔烃加成得到,故C不选;
D.新戊烷为C(CH3)4,不能由烯烃、炔烃加成得到,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、烯烃和炔烃加成后碳链结构为解答的关键,侧重分析与应用能力的考查,注意有机物结构中H的数目判断,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、H2SO4、NaOH | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NH3•H2O | D. | HCl、NH3•H2O、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有关苏糖的说法不正确的是( )
有关苏糖的说法不正确的是( )| A. | 苏糖能发生银镜反应 | |
| B. | 苏糖属于单糖 | |
| C. | 苏糖在一定条件下,能发生加成和取代反应 | |
| D. | 苏糖与葡萄糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,上述对青篙素的提取过程属于物理变化 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
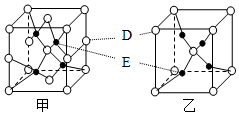 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com