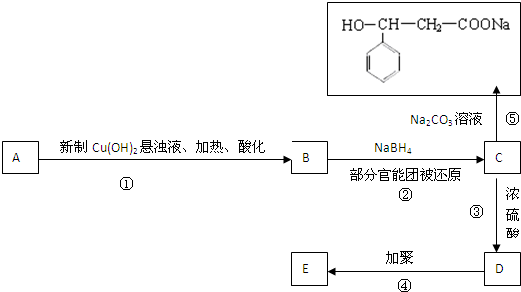
ij��ѧ��ȤС����ʵ������ȡƯ�ۣ���̽��������ʯ���鷴Ӧ�������Ͳ���
��֪���ٶ���������Ũ���ᷴӦ���Ʊ�������ͬʱ����MnCl
2���������ͼ�ķ�Ӧ�Ĺ����зų��������¶Ƚϸ�ʱ�������ͼ�ܷ������·�Ӧ��6Cl
2+6Ca��OH��
2 5CaCl
2+Ca��ClO
3��
2+6H
2O
����ȤС�����������ʵ��װ�ã�����ʵ�飮
��ش��������⣺
��1���ټ�װ���з�����Ӧ�Ļ�ѧ����ʽ��
��
����װ���е��Լ���
��������
��
�۸���ȤС����300mL 12mol/L������17.4g MnO
2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶñ��������
L��Ca��ClO��
2
g��
��2��С���Ա���֣�������Ca��ClO��
2����������С������ֵ���������ۺ���Ϊ����������δ��ʯ����
��Ӧ���ݳ����Լ��¶������ǿ���ԭ��Ϊ��̽����Ӧ�����Բ����Ӱ�죬������ȡһ������ʯ���飬���������ٵ�ͨ�������������ó���ClO
-��ClO
3-�������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���Ĺ�ϵ���ߣ����Ա�ʾΪ��ͼ��������������ˮ�ķ�Ӧ����
��ͼ�����ߢ��ʾ
���ӵ����ʵ����淴Ӧʱ��仯�Ĺ�ϵ��
����ȡʯ�����к���Ca��OH��
2�����ʵ���Ϊ
mol��
����ȡһ����ڵ����ʵ���Ca��OH��
2��ʯ���飬�Խϴ������ͨ��������������Ӧ���ò�����Cl
-�����ʵ���Ϊ0.35mol���������
=
��





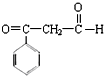 ��һ����Ҫ�Ļ���ԭ�ϣ�A��B��C��D��E֮���ת����ϵ��ͼ��
��һ����Ҫ�Ļ���ԭ�ϣ�A��B��C��D��E֮���ת����ϵ��ͼ��