
【题目】某有机物M的球棍模型如图所示:
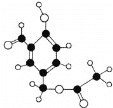
(1)请写出物质M的分子式_______含氧官能团名称_________
(2)M在一定条件下,可以发生水解反应,生成A、B两种物质(它们的相对分子质量关系A>B)。B可以用以下方法制得:X![]() Y
Y![]() Z
Z![]() W
W![]() B。其中W能发生银镜反应。则I属于________反应(填反应类型)
B。其中W能发生银镜反应。则I属于________反应(填反应类型)
(3)写出反应Ⅱ的化学方程式:_____。反应Ⅲ的化学方程式:________。
(4)1molA分别与Na、NaOH溶液反应,所用Na、NaOH物质的量的最大值之比是_______。
(5)A有多种同分异构体,符合下列三个件的同分异构体有_______种,其中分子结构中只有六种氢原子的结构简式为__________
a.环上只有两个取代基
b.与FeCl3溶液显紫色;
c.能发生银镜反应。
【答案】C10H10O4 羟基,醛基,酯基 加成反应 CH3CH2Cl + NaOH![]() CH3CH2OH+ NaCl 2CH3CH2OH + O2
CH3CH2OH+ NaCl 2CH3CH2OH + O2![]() 2CH3CHO + 2H2O 2:1 9
2CH3CHO + 2H2O 2:1 9 ![]()
【解析】
根据M的球棍模型可知,该有机物为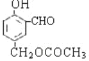 。根据M的结构
。根据M的结构 在一定条件下,可以发生水解反应,生成A、B两种物质,它们的相对分子质量关系A>B,则A为
在一定条件下,可以发生水解反应,生成A、B两种物质,它们的相对分子质量关系A>B,则A为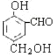 ,B为CH3COOH,由流程知W氧化生成B,又能发生银镜反应,则W为CH3CHO,Z氧化生成W,则Z为CH3CH2OH,所以反应Ⅰ为CH2=CH2与HCl发生加成反应生成CH3CH2Cl,反应Ⅱ为CH3CH2Cl在氢氧化钠水溶液中发生水解反应生成CH3CH2OH,所以X为CH2=CH2,Y为CH3CH2Cl。
,B为CH3COOH,由流程知W氧化生成B,又能发生银镜反应,则W为CH3CHO,Z氧化生成W,则Z为CH3CH2OH,所以反应Ⅰ为CH2=CH2与HCl发生加成反应生成CH3CH2Cl,反应Ⅱ为CH3CH2Cl在氢氧化钠水溶液中发生水解反应生成CH3CH2OH,所以X为CH2=CH2,Y为CH3CH2Cl。
(1)由M的球棍模型可知,该有机物为![]() ,则分子式为C10H10O4,含氧官能团名称为羟基、醛基、酯基。
,则分子式为C10H10O4,含氧官能团名称为羟基、醛基、酯基。
(2)根据以上分析,反应Ⅰ为CH2=CH2与HCl反应生成CH3CH2Cl,属于加成反应。
(3)反应Ⅱ为CH3CH2Cl在氢氧化钠水溶液中发生水解反应生成CH3CH2OH,反应方程式为CH3CH2Cl + NaOH![]() CH3CH2OH+ NaCl;反应Ⅲ乙醇催化氧化生成乙醛,化学方程式为2CH3CH2OH + O2
CH3CH2OH+ NaCl;反应Ⅲ乙醇催化氧化生成乙醛,化学方程式为2CH3CH2OH + O2![]() 2CH3CHO + 2H2O。
2CH3CHO + 2H2O。
(4)A为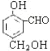 含有酚羟基、醇羟基和醛基,酚羟基、醇羟基能与钠反应,酚羟基能与氢氧化钠反应,则1molA最大与2molNa、1molNaOH溶液反应,所以Na、NaOH物质的量的最大值之比是2:1。
含有酚羟基、醇羟基和醛基,酚羟基、醇羟基能与钠反应,酚羟基能与氢氧化钠反应,则1molA最大与2molNa、1molNaOH溶液反应,所以Na、NaOH物质的量的最大值之比是2:1。
(5)A的同分异构体与FeCl3溶液显紫色,说明含有酚羟基; 能发生银镜反应,说明含有醛基,两个取代基分别为-OH与-CH(OH)CHO、-CH2OOCH、-OCH2CHO,两个取代基的位置为邻、间、对,同分异构体共9种;其中分子结构中只有六种氢原子的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某制药有限公司生产有多种型号的钙尔奇D片剂,为测定某型号片剂中碳酸钙含量,进行如下实验:取10片该片剂碾碎后放入足量的盐酸中充分反应(假设盐酸只与碳酸钙反应)后过滤,取滤液加(NH4)2C2O4使Ca2+生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中并稀释成1L溶液,取20.00mL,然后用0.0500mol·L-1KMnO4溶液滴定,反应中用去12.00mLKMnO4溶液,发生反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
请回答:
(1)该型号片剂中每片含碳酸钙的质量为_____克
(2)该公司一种“钙尔奇D600片剂”(其主要成分与题中某型号的片剂相同,仅仅是碳酸钙的含量不同)的部分文字说明如下:“本品每片含主要成分碳酸钙1.5g(相当于钙元素600mg),成人每天服用1片”。则某型号的片剂应称为“钙尔奇D_____(填数字)片剂。”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2![]() Cu2++2CH3COO-+2H2O
Cu2++2CH3COO-+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
D.甲酸溶液与足量的银氨溶液共热:HCOOH+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S↓+ 3H2O _______氧化剂_______
(2)2KMnO4 +5H2O2 + 3H2SO4 = K2SO4+2MnSO4+5O2↑ + 8H2O _______ 氧化剂_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应: xA(g)+yB(s)![]() zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
A.x+y>zB.平衡向正反应方向移动C.B的转化率增大D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扭曲烷( Twistane)是一种具有挥发性的环烷烃,其结构和球棍模型如图所示。下列说法正确的是( )

A.分子式为C10H18
B.与邻二乙苯互为同分异构体
C.分子结构中含有4个六元环
D.二氯代物多于3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
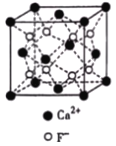
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m:n
B.同质量气体A与气体B的分子个数比为n:m
C.同温同压下,A气体与B气体的密度比为n:m
D.相同状况下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.2mol·L-1的Na2SO4溶液。回答下列问题:
(1)填写下列实验操作步骤中的空白处:
A.在天平上称取___gNa2SO4固体,把它放在___中,用适量的蒸馏水溶解;
B.把制得的溶液小心地沿着___注入___中;
C.继续向容量瓶中加入蒸馏水至液面离容量瓶颈刻度线下1~2cm时,改用___小心滴加蒸馏水至溶液凹液面最低处与刻度线水平相切;
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中,并轻轻摇匀;
E.盖好瓶塞,反复上下颠倒,摇匀。
(2)第(1)题中操作步骤的正确顺序是(填标号)___。
(3)下列情况中,会使所配溶液浓度偏高的是___(填标号)。
a.溶解搅拌时有部分液体溅出
b.加蒸馏水时,不慎超过了刻度线
C.在定容时,俯视刻度线
d.容量瓶使用前内壁沾有水珠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com