
| A. | NH4HCO3 | B. | KCl | C. | CO(NH2)2 | D. | KNO3 |
科目:高中化学 来源: 题型:选择题
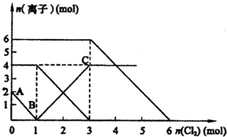 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
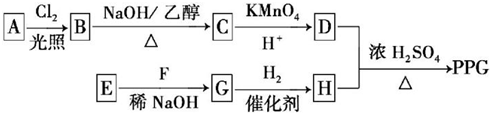
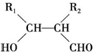 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+ | |
| B. | 某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- | |
| C. | 某溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+ | |
| D. | 某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
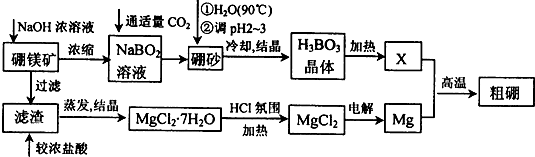
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
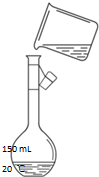 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com