
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
 4Fe3++2H2O
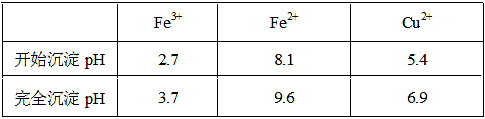
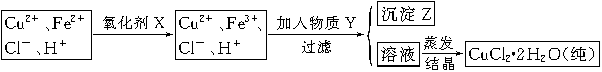
4Fe3++2H2O 4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。

科目:高中化学 来源:不详 题型:填空题
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是( )
NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是( )| A.加NaOH 固体 | B.加浓HCl | C.加NH4Cl固体 | D.加同浓度的氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该温度下,0.31 mol·L-1的HF溶液的pH=2 |
| B.升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C.两溶液混合不会产生沉淀 |
| D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaA溶液的pH>7(室温下) |
| B.pH试纸显示0.1 mol/L HA溶液的pH为2~3(室温下) |
| C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强 |
| D.HA溶液能与CH3COONa溶液反应生成CH3COOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.温度升高20℃后,两溶液pH均不变 |
| C.加水稀释2倍后,两溶液的pH同等程度减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| B.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+) |
| C.c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+) |
| D.c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com