
【题目】对C2H6和C5H12的分析错误的是( )
A. 互为同系物
B. C2H6失去1个H得到的乙基只有一种结构
C. C5H12的一氯代物可能只有一种
D. 2,2-二甲基丙烷的沸点高于其同分异构体的沸点
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
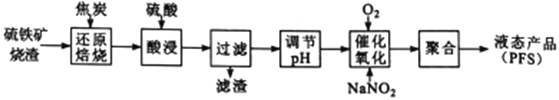
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。
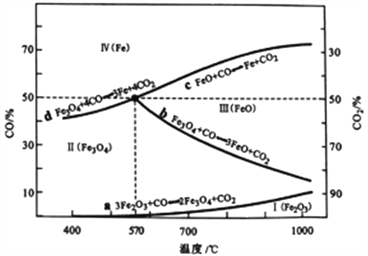
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
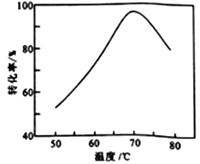
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,不正确的是( )
A.苯是一种重要的化工原料
B.苯有毒且易挥发,是一种无色无味的液体
C.溴在苯中的溶解度大且与水互不相溶,可以用苯萃取溴水中的溴
D.苯是一种易挥发、易燃的物质,放置苯的仓库要禁止烟火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol/L NaCl溶液中含有的钠离子数为NA
B. 1molN2与4molH2在密闭容器中充分反应生成的NH3分子数为2NA
C. 将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA
D. 10 g 46%的CH3CH2OH的水溶液中含氢原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
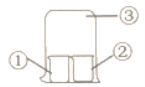
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.核外电子排布完全相同的两种粒子,其化学性质一定相同
B.难失电子的原子,一定具有强氧化性
C.离子化合物和共价化合物中都可能含有非极性键
D.共价化合物溶水电离过程中,共价键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知某纯碱试样中含有杂质NaCl,为了确定试样中纯碱的质量分数,可测定其在化学反应中生成CO2的质量,实验装置如下(铁架台及夹持仪器均已省略)。
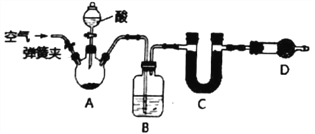
完成下列填空:
(1)B装置中的试剂是_____________,作用是_____________________________。
(2)D装置的作用是___________________________________。
II.测定试样中纯碱质量分数的某次实验步骤如下:①将10.000g纯碱试样放入A中 ②称量C(U型管+碱石灰,下同),质量为l05.160g ③使用分液漏斗滴加足量的酸,使充分反应 ④打开A的弹簧夹,缓缓鼓入一定量的空气 ⑤再次称量C ⑥重复步骤④和⑤,最后得到C的质量为109.l66g。
(3)步骤③中,滴加的酸最好选用________。
a、浓硝酸 b、稀盐酸 c、浓硫酸 d、稀硫酸
当看到____________________现象时即可进行第④步操作。
(4)步骤⑥的目的是_______________________________________________。
(5)由实验数据可知,试样中纯碱的质量分数为_________________(保留3位小数)。
(6)甲同学用上述装置测定某试样中纯碱的质量分数,结果偏高,请帮助他找出造成实验误差的原因。_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com