
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为__。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是_____。
A.C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A分子中所有的碳原子在同一平面上,且该分子的一氯取代物只有一种。则A的结构简式为__。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__。
【答案】C6H12 A C ![]()
![]()
【解析】
(1)某烃A的相对分子质量为84,则烃中C原子最大数目=![]() ,因为烃中还含有H元素,所以C原子数目为6,则H原子数为12,故有机物分子式为C6H12;
,因为烃中还含有H元素,所以C原子数目为6,则H原子数为12,故有机物分子式为C6H12;
(2)烃的通式为CxHy,若总物质的量一定,若各组分耗氧量(x+![]() )相等,则消耗氧气的量相等,否则不相等,C6H12的耗氧量为9,C7H8的耗氧量为9,所以二者混合总物质的量一定,充分燃烧消耗氧气的量不变,选A;
)相等,则消耗氧气的量相等,否则不相等,C6H12的耗氧量为9,C7H8的耗氧量为9,所以二者混合总物质的量一定,充分燃烧消耗氧气的量不变,选A;
若总质量一定,充分燃烧消耗氧气的量不变,两种烃的最简式相同,C6H12的最简式为CH2,C7H14的最简式为CH2,选C;
(3)若烃A为链烃,应含有一个碳碳双键,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A为 ;
;
若A不能使溴水褪色,则不含碳碳双键,应为环状结构,若其一氯代物只有一种,则A为环己烷,结构简式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,其中X、Y、Z均为短周期元素,它们的位置关系如图所示,已知三种元素的质子数之和为31,写出:
X | ||
Y | Z |
(1)写出X、Y、Z的元素符号:___、___、___。
(2)写出Y元素的离子结构示意图:___。
(3)元素Y和Z的金属性较强的是___(填元素符号)。
(4)Z是大自然赐予人类的宝物。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为___,Z表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C.有熔融物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是( )

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,其质谱图如图所示,则:
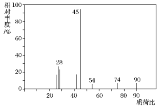
(1)C的分子式是___。
(2)若C能与NaHCO3溶液发生反应,则C中一定含有的官能团名称是_____。又知C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是_____。写出C与NaHCO3溶液反应的化学方程式__。
(3)0.1molC与足量Na反应,在标准状况下产生H2的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将mg铜粉和锌粉的混合物分成两等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L(标准状况下);将另一份在空气中充分加热,的到n g固体,将所得固体溶于上述稀硝酸,消耗硝酸的体积为V ml。下列说法不正确的是
A.V=150Ml
B.硝酸的浓度为2 mol·L-1
C.m g铜粉和锌粉的物质的量之和为0.3 mol
D.n=m+2.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂电池充电时阳极反应式为:LiFePO4 -xLi+ -xe-→ xFePO4 + (1-x)LiFePO4。放电工作示意图如下图。下列叙述不正确的是

A.放电时,Li+ 通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4
D.该电池充放电过程通过Li+ 迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA2 +bB2![]() xX(反应物、生成物都是气体)。回答下列问题:
xX(反应物、生成物都是气体)。回答下列问题:
I.将一定量的两种反应物置于恒容绝热反应器中(与外部环境无热量交换的反应器),反应器内的温度与时间的关系如图:

(1)该反应是___ (填“吸”或“ 放”)热反应。
(2)下列关于该反应的叙述正确的是____ (填字母)。
a A点反应停止 b A点速率不为零
c 反应物的总能量大于生成物的 d B点正反应速率大于逆反应速率
II.将一定量的上述反应的反应物与生成物置于容积为2L的恒温恒容反应器中,反应器中各物质的物质的量与时间的关系如图:

(3)①反应前4 min物质x的物质的量的变化为_____mol. .
②反应前4 min物质A2反应速率为_______
③该可逆反应的化学方程式为______(物质X用A、B表示)。
④如果在4 min时升高反应体系的温度.则反应速率___ ( 填“增大“减小”或“不变")。
⑤如果在4min时加入2.4 mol Ne(Ne不参与该反应),则反应速率___ (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com