
【题目】元素周期表是一座开放的“元素大厦”,元素大厦尚未充满。若发现119号元素,请您在元素大厦中安排好它的“房间”
A. 第八周期第ⅠA族B. 第七周期第0族
C. 第七周期第ⅦA族D. 第六周期ⅡA族
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )

A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置分别进行下列各组物质的导电性实验,小灯泡的亮度比反应前明显减弱的是

A. 向亚硫酸钠溶液中通入氯气
B. 向硝酸银溶液中通入少量氯化氢
C. 向氢碘酸饱和溶液中通入少量氧气
D. 向氢氧化钠溶液中通入少量氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
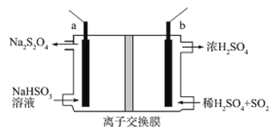
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钠、氯及其化合物间有如下转化关系,
请按要求填空:
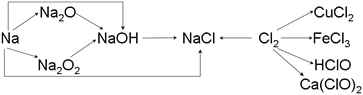
(1)实验室中金属钠通常保存在_______中,一小块金属钠投入水中反应的化学方程式是________________。
(2)Na2O2常用于呼吸面具中,有关反应的化学方程式为_____________________________,_________________________________。
(3)新制的氯水滴入紫色石蕊试液中,观察到的现象是___________________________。
请写出氯气与水反应的化学方程式_______________________________。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由间苯二酚合成2-硝基-1,3-苯二酚的原理如下:

已知:
物质 | 间苯二酚 | 2-硝基-1,3-苯二酚 |
熔点 | 109~112℃ | 84.85℃ |
沸点 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相对分子质量 | 110 | 155 |
实验药品:间苯二酚、浓硫酸(98%)、混合酸(由浓硝酸和浓硫酸按2:3的体积比混合而成)、尿素等。
实验步骤:
Ⅰ.称取2.7g间苯二酚粉末,放入100mL锥形瓶中,再加入13mL浓硫酸,同时充分搅拌,反应放热,立即生成白色磺化物。
Ⅱ.当反应物冷却后,用滴管滴加预先用冰水浴冷却好的混合酸,同时进行搅拌,并使反应温度不超过30℃.将生成的黄色粘稠状液体在室温下放置15min,再用7.5mL带有碎冰的冷水稀释,保持温度在50℃以下,得到红褐色的稠状液体。
Ⅲ.将反应液转移至250mL烧瓶中(如右下图所示,夹持和加热装置均已略去),再加入0.1g尿素,进行蒸馏,蒸馏液通过抽滤,洗涤干燥后,可得到橘红色片状晶体粗品。

试回答下列问题:
(1)进行产物蒸馏时,冷却水应从______(填“a”或“b”)口进入。
(2)实验过程中,温度控制在较低温度下进行的原因可能是:______。
(3)实验过程中配制混酸的正确操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反应而被除去。其中反应之一的化学方程式为:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(标准状况下)时,则转移的电子数为______。
(5)对粗品进行(方法)可提高产品纯度。若干燥后称量所得产品的质量为 2.1g,则其产率为______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com