
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
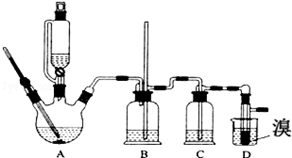
分析 由图可知,三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;实验目的制备少量1,2-二溴乙烷,D是发生的反应是乙烯与溴发生加成反应生成1,2-二溴乙烷,因1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,且乙烯与溴反应时放热,冷却可避免溴的大量挥发,但不能过度冷却(如用冰水),否则使气路堵塞,1,2-二溴乙烷和水不互溶,密度比水大,因Br2能与NaOH溶液反应,且1,2-二溴乙烷与水互不相溶,以此来解答.
解答 解:(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,二氧化碳在水中溶解度小,二氧化碳、二氧化硫能和氢氧化钠溶液反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,则利用NaOH溶液吸收,
故答案为:减少副产物乙醚生成;NaOH溶液;
(3)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,则将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层,若产物中有少量未反应的Br2,可用NaOH溶液洗涤,
故答案为:下;NaOH溶液;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,故答案为:如果用冰水冷却会使产品凝固而堵塞导管.
点评 本题考查制备实验方案,为高频考点,把握有机物的性质、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
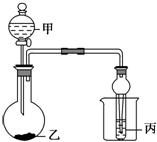 利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )| 选项 | 甲 | 乙 | 丙 | 实验现象 | 实验结论 |
| A | 浓盐酸 | 石灰石 | NaAlO2溶液 | 乙中有无色气泡,丙中先出现沉淀后消失 | 氢氧化铝溶于碳酸 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 乙中蔗糖变黑色、丙中溴水褪色 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 乙中有无色气泡,丙中出现白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 乙中有无色气泡,丙中出现白色沉淀 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Na2CO3和1.6mol NaOH | B. | 1mol Na2CO3与0.6mol NaHCO3 | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 1mol Na2CO3和0.6mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和AgNO3溶液反应 | Cu+Ag+═Cu2++Ag | 正确 |
| B | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-═2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| D | 钠与硫酸铜溶液反应 | 2Na+Cu2+═Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
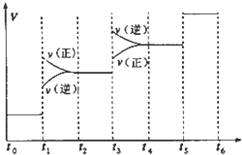 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
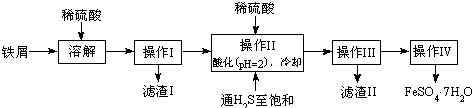
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com