
【题目】将一定量的氯气通入60 mL浓度为10.00 mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-) 可能为7∶3
C.若反应中转移的电子为n mol,则0.3 n 0.5
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶1∶2
【答案】B
【解析】
A.由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.06L×10mol/L=0.6mol,,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.6mol,故参加反应的氯气n(Cl2)=0.3mol,故A不符合题意;
B.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl)最小为6:5,故6:5<n(Na+):n(Cl)<2:1,7:3>2:1,故B符合题意;
C.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.6mol×![]() ×1=0.3mol,氧化产物只有NaClO3,转移电子数最多,为0.6mol×
×1=0.3mol,氧化产物只有NaClO3,转移电子数最多,为0.6mol×![]() ×1=0.5mol,所以若反应中转移的电子为nmol,则0.3<n<0.5,故C不符合题意;
×1=0.5mol,所以若反应中转移的电子为nmol,则0.3<n<0.5,故C不符合题意;
D.令n(NaCl)=11mol,n(NaClO)=1mol,n(NaClO3)=2mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为1mol×1+2mol×5=11mol,得失电子相等,故D不符合题意;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】下列有机物中含有少量杂质![]() 括号中是杂质
括号中是杂质![]() ,除杂方法正确的是
,除杂方法正确的是
A.乙醇![]() 乙酸
乙酸![]() :加入碳酸钠溶液,振荡,静置,分液
:加入碳酸钠溶液,振荡,静置,分液
B.硝基苯![]() 硫酸
硫酸![]() :将其加入NaOH溶液中,振荡,静置,分液
:将其加入NaOH溶液中,振荡,静置,分液
C.乙醛![]() 乙酸乙酯
乙酸乙酯![]() :加入氢氧化钠溶液,振荡,静置,分液
:加入氢氧化钠溶液,振荡,静置,分液
D.溴乙烷![]() 溴
溴![]() :加入四氯化碳,振荡,静置,分液
:加入四氯化碳,振荡,静置,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+![]() Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 X中可能含有如下离子:Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
A.取溶液X进行焰色反应,火焰呈黄色。说明溶液不含K+
B.取固体Y加入过量的稀盐酸,沉淀部分溶解。说明溶液X含![]() 、不含
、不含![]()
C.取滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。说明溶液X中含Cl-
D.取滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。说明溶液X中含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芥子醇是一种合成工程纤维的单体,结构简式如图。有关芥子醇的说法中正确的是
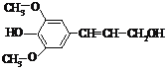
A.能与3 mol NaOH溶液反应
B.能通过与浓溴水的反应证明存在酚羟基
C.能发生的反应类型有氧化、取代、加成
D.能与钠反应、不能与碳酸钠和碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )

A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是 ( )
①O2、O3、O2-、O22—互为同素异形体
②乙烯和乙炔互为同系物
③35Cl、37Cl互为同位素
④乙酸![]() 和羟基乙醛
和羟基乙醛![]() 互为同分异构体
互为同分异构体
A.①②B.②③C.①③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com