
将12.8 g铜跟一定量的浓硝酸反应,待铜耗尽时,共产生气体5.6 L(标准状况下)。计算被还原的HNO3的物质的量是多少?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:山西省山大附中2011-2012学年高二5月月考化学试题 题型:058
Ⅰ.某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题.
(1)配制100 mL 1 mol/L的NH4Cl溶液.该同学应用托盘天平称量NH4Cl固体的质量为________g.
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器.
①还缺少的仪器有________;
②使用容量瓶前必须进行的一步操作是________;
(2)该同学又用下图所示的装置做了有关氨气的性质实验.
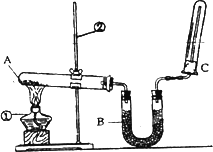
①写出实验室制氨气的化学方程式:________;
②写出B中盛放的是碱石灰其作用是________;
③氨气极易溶于水,在氨水中滴加酚酞现象是________;
④检验氨气的方法是________.
Ⅱ.在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为________;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是________.(用离子方程式表示)
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况下).则所消耗的硝酸的物质的量是________.
查看答案和解析>>
科目:高中化学 来源:2013届河南省南阳市一中高三9月月考理科综合化学试卷(带解析) 题型:计算题
(16分). 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ. 实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为: 。
(2)反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 mol。
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示: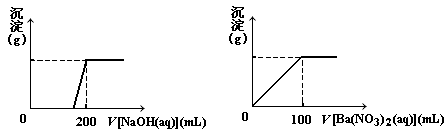
(1) 请通过计算确定m的值;
(2) X的摩尔质量为368 g/mol,请确定X的化学式。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省南阳市高三9月月考理科综合化学试卷(解析版) 题型:计算题
(16分). 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ. 实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为: 。
(2) 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 mol。
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
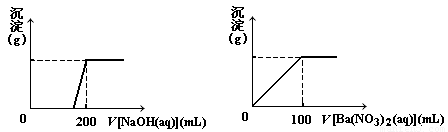
(1) 请通过计算确定m的值;
(2) X的摩尔质量为368 g/mol,请确定X的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com