
【题目】(1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量是7.60 g,则混合气体中甲烷的体积为________,一氧化碳的质量为_______。
(2)现有CO、CO2的混合气体,根据下列条件回答问题
①若该混合气体在标准状况下的密度为1.79 g/L,则混合气体中CO的体积分数为__________。
②若标准状况下,2.24 L该混合气体的质量为4 g,则混合气体中CO和CO2的物质的量之比为_________。
(3)一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量是7.2 g,若其中水的质量为3.6 g,则CO的质量是_________。
(4)在一定条件下,某固体化合物X受热分解方程式为: 2X = A↑+2B↑+3C↑,测得反应后生成的混合气体对H2的相对密度为11。在相同条件下,X的相对分子质量是_____________。
【答案】6.72 L 2.8 g 25% 1:3 1.4 g 66
【解析】
(1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,物质的量为![]() ,其质量是7.60 g,列方程可求出甲烷和一氧化碳的物质的量,从而求出甲烷的体积和一氧化碳的质量。
,其质量是7.60 g,列方程可求出甲烷和一氧化碳的物质的量,从而求出甲烷的体积和一氧化碳的质量。
(2)①可假设混合气为1mol,则其体积为22.4L,若该混合气体在标准状况下的密度为1.79 g/L,则混合气的质量为22.4L×1.79g/L=40g,列方程可求出CO的物质的量,由此求出体积分数。
②若标准状况下,2.24 L该混合气体为0.1mol,质量为4 g,列方程可求出混合气体中CO和CO2的物质的量,从而求出物质的量之比。
(3)利用水的质量为3.6 g,求出n(H2O)=![]() ,从而求出n(CH4)=n(C)=0.1mol,利用7.2g列方程可求出CO的质量。
,从而求出n(CH4)=n(C)=0.1mol,利用7.2g列方程可求出CO的质量。
(4)利用阿伏加德罗定律的推论,可求出混合气的平均相对分子质量为11×2=22,再假设X为2mol,则依据方程式2X = A↑+2B↑+3C↑,混合气体为6mol,然后利用质量守恒建立等量关系式,从而求出X的相对分子质量。
(1)n(混)=![]() ,其质量是7.60 g
,其质量是7.60 g
设甲烷的物质的量为x,则一氧化碳的物质的量为0.4-x
16x+28(0.4-x)=7.6 x=0.3mol
V(CH4)=0.3mol×22.4L/mol=6.72L,m(CO)=0.1mol×28g/mol=2.8g。答案为:6.72 L;2.8 g;
(2)①可假设混合气为1mol,则其体积为22.4L,若该混合气体在标准状况下的密度为1.79 g/L,则混合气的质量为22.4L×1.79g/L=40g,
设CO的物质的量为y,则CO2的物质的量为1-y
28y+44(1-y)=40 y=0.25mol CO的体积分数为![]() ;答案为:25%;
;答案为:25%;
②若标准状况下,2.24 L该混合气体为0.1mol,质量为4 g,
设CO物质的量为z,则CO2的物质的量为0.1-z
28z+44(0.1-z)=4 z=0.025mol,0.1-z=0.075mol,n(CO):n(CO2)=1:3;答案为:1:3;
(3)水的质量为3.6 g,n(H2O)=![]() ,从而求出n(CH4)=n(C)=0.1mol,
,从而求出n(CH4)=n(C)=0.1mol,
设CO物质的量为x
则28x+44(0.1-x)+3.6=7.2 x=0.05mol
m(CO)=0.05mol×28g/mol=1.4g。答案为:1.4g;
(4)利用阿伏加德罗定律的推论,可求出混合气的平均相对分子质量为11×2=22,再假设X为2mol,则依据方程式2X = A↑+2B↑+3C↑,混合气体为6mol,
依据质量守恒建立,可得:2mol×M(A)=6mol×22g/mol,M(A)=66。答案为:66。


科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,部分性质及转化关系如图:
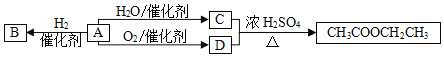
请回答:
(1)D中官能团的名称是_____。
(2)A→B的反应类型是_____。
A.取代反应B.加成反应C.氧化反应
(3)写出A→C反应的化学方程式_____。
(4)下列说法不正确的是_____。
A.B物质不能使溴水和酸性高锰酸钾褪色
B.A在一定条件下可与氯化氢发生加成反应
C.有机物C、D可用金属钠鉴别
D.A分子所有原子在同一个平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
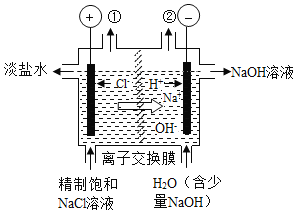
A. 装置出口①处的物质是氯气
B. 出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C. 装置中发生的反应的离子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D. 该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
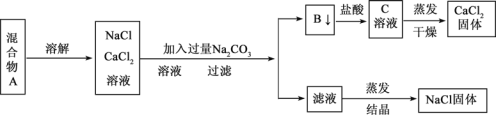
回答下列问题
(1)方案中反应的离子方程式是 __________、________________。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一设计有毛病,这一步的正确设计方案应是____________________________。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B 物质和另一物质的质量,这种物质是__________________。(填物质对应的字母)
(4)实验过程中检验洗涤 B 物质是否洗净的方法是___________________。
(5)该实验过程中需要0.1mol/L的Na2CO3溶液450 mL,实验老师用碳酸钠晶体(Na2CO3·10H2O)配制该浓度的溶液。请你协助老师完成下列问题:
① 配制Na2CO3溶液时需要的主要玻璃仪器有烧杯、玻璃棒、___________________。
② 该实验的第一步是计算,称取_________g碳酸钠晶体。
③ 若定容时仰视刻度线,则所配制的溶液浓度_____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢工艺方面取得突破性进展,CO2转化过程示意图如图,下列说法不正确的是( )
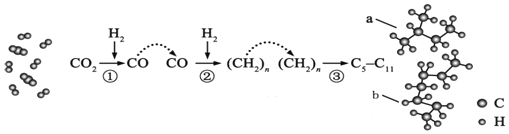
A. 过程![]() 中的产物中含有
中的产物中含有![]()
B. 该工艺在一定程度上能够拓宽获取汽油的途径
C. 产物中a和b互为同系物
D. 图中a的比例模型名称是![]() 甲基丁烷
甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得,下列有关叙述正确的是( )
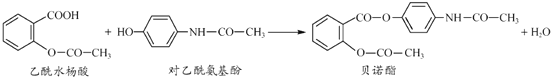
A. 根据有机物的分类,贝诺酯属于芳香烃,分子式为![]()
B. 乙酰水杨酸和对乙酰氨基酚均能与![]() 溶液反应放出
溶液反应放出![]()
C. 乙酰水杨酸和对乙酰氨基酚可用![]() 溶液区别
溶液区别
D. 1mol乙酰水杨酸最多能与2molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2+2NH3![]() CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
A.中子数为8的碳原子:![]() CB.NH3的电子式:
CB.NH3的电子式:![]()
C.氧原子的结构示意图:![]() D.CO(NH2)2的结构简式:
D.CO(NH2)2的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。
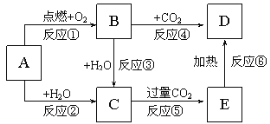
回答下列问题:
(1)写出化学式:A___,D___。
(2)以上反应中不属于氧化还原反应的有___(填序号)。
(3)反应③的离子方程式:___。氧化剂为___;氧化产物为___。
(4)向D溶液中通入CO2反应的化学方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com