
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
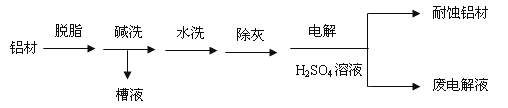
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
【答案】(1)①2Al + 2OH-+ 4H2O=2Al(OH)4-+ 3H2; c
②2Al + 3H2O -6e-→Al2O3+6H+; 因为Al3+和HCO3-发生互促水解;Al3++ 3HCO3-==Al(OH)3↓+3CO2↑
(2)阳极Cu可以发生氧化反应生成Cu2+
(3)N 牺牲阳极保护法
【解析】试题分析:铝材碱性可以洗去油污,同时也可以洗去表面的氧化铝,裸露的铝会和碱溶液反应放出氢气,2Al+2OH-+2H2O=2AlO2-+3H2↑,氢氧化铝是两性氢氧化物,可溶于强酸强碱,因此,溶液中的偏铝酸根,应通入CO2使其沉淀成氢氧化铝,选b,②以铝材为阳极,在过量的H2SO4溶液中电解,铝材表面形成氧化膜,铝失电子发生氧化反应,阳极电极反应式为2Al-6e-+3H2O=Al2O3+6H+,取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,原因溶液中有硫酸,还有硫酸铝,HCO3-+ H+= CO2↑+ H2O,Al3++3HCO3-=Al(OH)3↓+3CO2↑,(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定。(3)若X为碳棒,为减缓铁的腐蚀,应构成电解池,阴极的电保护法,开关K应该置于N处,若X为锌,开光K置于M处,该电化学防护法称为牺牲阳极的阴极保护法。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
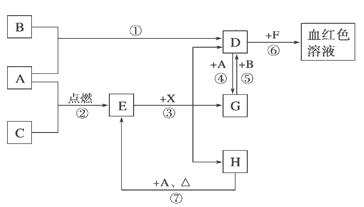
(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Fe(CN)6]3可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是

A. 电解时阳极反应式为[Fe(CN)6]4e![]() [Fe(CN)6]3
[Fe(CN)6]3
B. 电解时阴极反应式为2HCO3-+2e![]() H2↑+2CO32-
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,恒定的容器中进行下列反应:N2O42NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
A. 等于10s B. 等于5s C. 大于10s D. 小于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.3g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A. 7.2g B. 3.6g C. 2.3g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
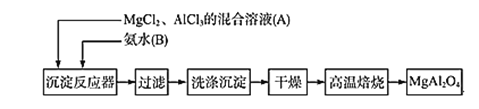
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净的方法是__________________________________________,高温焙烧时,用于盛放固体的仪器名称是________________。
Ⅱ.无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
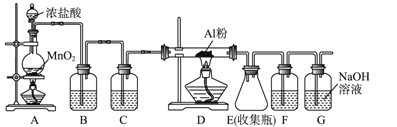
(3)其中装置A用来制备氯气,写出其化学反应方程式______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的离子方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
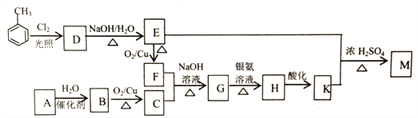
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
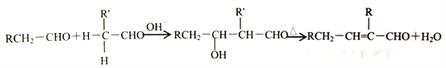
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. H2SO3![]() 2H++SO32— B. NaHCO3
2H++SO32— B. NaHCO3![]() Na++HCO3— C. HF+H2O
Na++HCO3— C. HF+H2O![]() F-+H3O+ D. Ba(OH)2
F-+H3O+ D. Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com