
| A. | 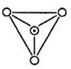 | B. |  | ||
| C. |  | D. |  |
分析 SiO32-中Si、O原子个数之比为1:3,根据图中Si、O原子个数比是否是1:3来分析解答.
解答 解:SiO32-中Si、O原子个数之比为1:3,
A.该微粒中Si、O原子个数比为1:4,不符合,故A错误;
B.该微粒每个结构单元中Si、O原子个数之比=1:(2+2×$\frac{1}{2}$)=1:3,符合,故B正确;
C.该微粒中Si、O原子个数之比=2:7,不符合,故C错误;
D.该微粒中Si、O原子个数之比=6:(8+4×$\frac{1}{2}$)=3:5,不符合,故D错误;
故选B.
点评 本题考查硅酸根离子判断,侧重考查学生分析计算能力,采用均摊法分析解答即可,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H4O和C3H6O均满足饱和一元醛的通式,因此它们一定互为同系物 | |
| B. | 乙烯和苯均可使溴水褪色,但是其褪色原理不同 | |
| C. | 乙烯和苯分子中各原子都在同一平面 | |
| D. | 检验乙烷中是否含有乙烯,试剂为酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃CnH2n+2 | B. | 醇CnH2n+2O | C. | 醛CnH2nO | D. | 羧酸CnH2nO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,改变反应物的量,△H发生改变 | |
| B. | 上述反应生成1mol SO3,放热少于98.5KJ | |
| C. | 相同条件下加入2molSO2(g)、1mol O2(g) 充分反应放热等于197KJ | |
| D. | 相同条件下加入1molSO2(g)、0.5mol O2(g) 充分反应放热为Q1 kJ,若在相同容器中加入1mol SO3充分反应吸热等于Q2kJ,Q1kJ+Q2 kJ=98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 在25°C、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ量,则表示H2燃烧热的化学方程式 2H2(g)+O2(g)═2H2O(l)△H=-571kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为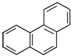 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体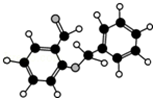 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com