
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
| 选项 | Ⅰ | Ⅱ |
| A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
| B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
| C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
| D | 少量氨水滴入AlCl3溶液中 | 少量AlCl3溶液滴入氨水中 |
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
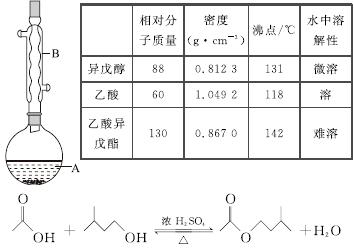
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。

a. b.
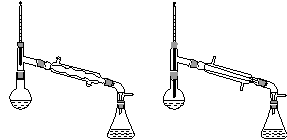
c. d.
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或说法错误的是( )
A.蒸发时,蒸发皿中的固体不能蒸干才停止加热
B.蒸馏时,温度计的水银球应靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | C(OH-)=1X10-13mol/l溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应3Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C | 溶液中: K+、Cu2+、Cl-、NH3•H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
| D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要O.1 mol/L NaOH溶液450 mL和0.5mol/l硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
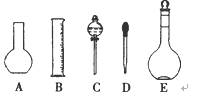
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.配制任意浓度和体积的标准溶液
D.稀释某一浓度的溶液
E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)O.1 mol/l。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔 B.丙炔 C.丁炔 D.丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是反应2A + 3B = C + 4D在不同时刻测得的速率,其中最快的是
A.V(A)=0.6mol/L.s B.V(B)=0.9mol/L.s
C.V(C)=0.4mol/L.s D.V(D)=1.0mol/L.s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com