
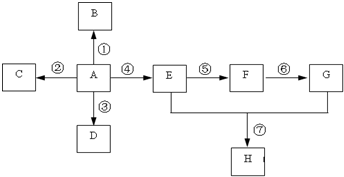
 已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.
已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.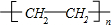 ;
;分析 A是一种重要的基本化工原料,相对分子量小于30,只能为烃,结合H原子饱和碳的四价结构可知,只能有2个碳原子,则Mr(A)=$\frac{2×12}{85.7%}$=28,故A为CH2=CH2,B为高分子化合物,乙烯发生加聚反应生成高聚物B为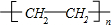 ,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,C为无色无味气体,实验室中可以通过G与大理石制取,乙烯燃烧生成C,则C为CO2,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,据此解答.
,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,C为无色无味气体,实验室中可以通过G与大理石制取,乙烯燃烧生成C,则C为CO2,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,据此解答.
解答 解:A是一种重要的基本化工原料,相对分子量小于30,只能为烃,结合H原子饱和碳的四价结构可知,只能有2个碳原子,则Mr(A)=$\frac{2×12}{85.7%}$=28,故A为CH2=CH2,B为高分子化合物,乙烯发生加聚反应生成高聚物B为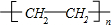 ,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,C为无色无味气体,实验室中可以通过G与大理石制取,乙烯燃烧生成C,则C为CO2,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,
,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,C为无色无味气体,实验室中可以通过G与大理石制取,乙烯燃烧生成C,则C为CO2,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,
(1)由上述分析可知,A为CH2=CH2,含有碳碳双键,E为CH3CH2OH,含有羟基,
故答案为:碳碳双键;羟基;
(2)反应①是乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2$\stackrel{一定条件}{→}$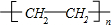 ,
,
反应④是乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
反应⑦是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O,
故答案为:n CH2=CH2$\stackrel{一定条件}{→}$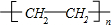 ;CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O;
;CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O;
(3)反应①乙烯发生加聚反应生成聚乙烯,反应②是乙烯燃烧生成二氧化碳,属于氧化反应,故答案为:加聚反应;氧化反应.
点评 本题考查有机物推断,根据相对分子质量确定A为乙烯,再结合E、G为生活中常见的有机物进行推断,分析发生的反应,比较基础,注意对基础知识的理解掌握,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL | |
| B. | 称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8gNaOH固体,放入100mL烧杯中,将烧杯中加满蒸馏水,同时不断搅拌至固体溶解 | |
| D. | 用100mL量筒量取40ml 5mol/L NaOH溶液,稀释后转移至100ml容量瓶中,洗涤并定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中加入双氧水 | |
| B. | 硫酸亚铁酸性溶液中滴加硝酸钾溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3 ④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com