
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
分析 A.双氧水被称为绿色氧化剂,被还原生成水;
B.水是浓盐酸和浓硝酸按体积比3:1配成的混合物;
C.氨水浓度越大,密度越小;
D.新制氯水含有氯气分子、水分子、次氯酸分子,盐酸电离、次氯酸电离、水电离.
解答 解:A.双氧水被称为“绿色氧化剂”,是因为其还原产物为水,对环境没有污染,故A错误;
B.水是浓盐酸和浓硝酸按体积比3:1配成的混合物,不是浓硫酸,故B错误;
C.氨水密度比水小,浓度越大,密度越小,故C错误;
D.新制氯水含有三种分子氯气分子、水分子,次氯酸分子;四种离子为氢离子、氢氧根离子、氯离子、次氯酸根离子,故D正确.
故选D.
点评 本题考查了氨气、氯气、过氧化氢、王水等物质的性质应用和微粒判断,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:解答题
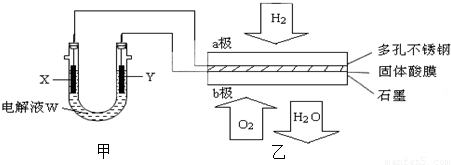
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 33% | C. | 60% | D. | 36% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
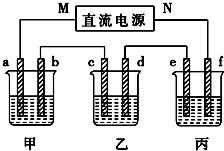 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
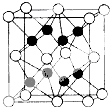 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: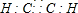 、
、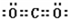 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com