
| 2.7g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 3.1g-1.2g-0.3g |
| 16g/mol |
| 3.1g |
| 62g/mol |
| 0.1 |
| 0.05 |
| 0.3 |
| 0.05 |
| 0.1 |
| 0.05 |
| 22.4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、这四种元素处于同一周期 |
| B、离子半径:A2+>B+>C->D2- |
| C、A与D的质子数相差4 |
| D、还原性:C-<D2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,向0.1mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| B、25℃时,NaB溶液的pH=8,c(Na+)+c(B-)=9.9×10-7mol?L-1 |
| C、0.1mol?L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| D、同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
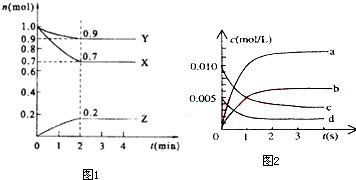
查看答案和解析>>
科目:高中化学 来源: 题型:
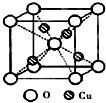 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
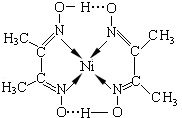
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com