
| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | D. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
科目:高中化学 来源: 题型:选择题
 已知碳碳单键可以绕键轴自由旋转,苯环为平面结构,现在有一种结构简式为如图所示的烃,下列说法中正确的是( )
已知碳碳单键可以绕键轴自由旋转,苯环为平面结构,现在有一种结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 分子中至少有16个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液体呈紫红色 | |
| B. | 液体分层,上层为紫色,下层接近无色 | |
| C. | 液体分层,上层接近无色,下层为紫色 | |
| D. | 液体无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌、铜电极和稀硫酸溶液构成的原电池中铜是正极 | |
| B. | 在镀件上镀铜时可用金属铜作阳极 | |
| C. | 用电解法精炼粗铜时粗铜发生氧化反应 | |
| D. | 用电解法精炼粗铜时纯铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
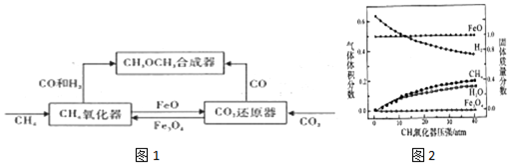
| 温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等物质的量的CO与CO2中所含碳原子数之比为2:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com