
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)  NH3(g) + HI(g) ②2HI(g)
NH3(g) + HI(g) ②2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,c(H2)=0.5mol/L,c(NH3)=4mol/L,则此温度下反应①的平衡常数为
A.9 B.12 C.16 D.20
科目:高中化学 来源:2016届吉林省高一教学评估(一)化学试卷(解析版) 题型:选择题
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH + 3H+ + NO3—= Cu2++ NO↑+ 2H2O
D.CuH在氯气中燃烧:CuH + Cl2= CuCl + HCl
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:填空题
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列混合物的分离方法不正确的是( )
A.水和汽油的混合物用分液方法分离
B.石灰水中悬浮的固体碳酸钙用过滤方法分离
C.碘水中的碘用酒精萃取分离
D.乙醇中溶解微量食盐,用蒸馏方法分离
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:填空题
工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+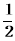 O2(g) →
O2(g) →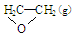 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为 kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
下列描述不符合生产、生活实际的是
A.家用炒锅残留盐溶液时易发生吸氧腐蚀
B.电解法精炼粗铜,用纯铜作阴极
C.电解水制氢气时,用铜作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:填空题
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
元素ABCD
性质结构信息原子中最外层电子数为电子层数的2倍。常温下为淡黄色固体,其燃烧热为Q KJ/mol单质常温、常压下是气体,能溶于水。原子的M层p轨道有1个未成对的电子 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。
(1)写出A的燃烧热方程式 。
(2)写出B单质与水反应的化学方程式 。
(3)电解B与C的化合物水溶液是重要化学工艺,写出离子方程式 。
(4)A与C形成的化合物存在的化学键为 (填“共价键”或“离子键”)。
(5)A、B、D三种元素电负性由小到大的顺序为 (写元素符号)。
(6)B、D两元素非金属性较弱的是 (写元素符号)。请设计一个实验证明这一结论: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
A.v正 增大,v逆减小 B.v正减小,v逆增大
C.v正和v逆同程度的减小 D.v正和v逆不同等程度的减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com