
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙===丁+己,甲+丙===戊+己;0.1 mol·L-1丁溶液的pH为13(25 ℃)。下列说法中正确的是( )。
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1 mol甲与足量的乙完全反应共转移了1 mol电子
D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
Fe、Cu都是人类最早使用的金属。某校化学研究性学习小组的同学运用实验手段研究Fe、Cu的相关性质,请你参与研究并完成下列各题:
(1)甲同学取一束细铜丝用砂纸打磨后放在酒精灯上加热至红热,然后迅速伸入盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是__________
_________________________________________________________________。
(2)乙同学为探究Fe在冷浓硝酸和热浓硝酸中的反应情况,设计了如图所示的实验装置:
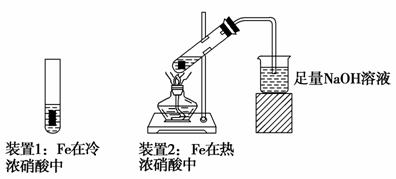
①乙同学发现装置1中Fe未溶解,其原因是_____________________________
_________________________________________________________________;
②装置2生成的气体(假定为NO2和NO混合气体)全部通入100 mL 4 mol·L-1 NaOH溶液,恰好被完全吸收,反应为:NO+NO2+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
若生成NaNO3和NaNO2物质的量之比为1∶3,则混合气体中NO2和NO的体积比为________。
(3)丙同学在Fe和浓硝酸反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。
①丙同学依据反应现象得出Cu片溶 解的原因是和HNO3发生反应。他依据的反应现象是_______________________________________________________
解的原因是和HNO3发生反应。他依据的反应现象是_______________________________________________________
_________________________________________________________________。
②丁同学认为丙同学的结论不完全正确,他的理由是_____________________
_________________________________________________________________。
(4)请你设计实验证明(3)反应后的溶液中只含Fe2+而不含Fe3+。说明具体实验操作和实验现象:___________________________________________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质(括号内的物质)方法正确的是
A.CO2(CO),通入适量O2点燃
B.KNO3溶液(AgNO3),加适量NaCl溶液,过滤
C.NaCl溶液(I2),加酒精,分液
D.CaO(CaCO3),加热灼烧至质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断:

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、CuSO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与 H2S反应生成S
H2S反应生成S
⑤Cl原子最外层有7个电于,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①②
C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化学键使得一百多种元素构成了世界的万物。关于化学键的下列叙述中,正确的是( )。
A.离子化合物中一定含有共价键,共价化合物中不含离子键
B.共价化合物中可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有 共价键
共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、
原子核与原子核之间的排斥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
下面所 列的是一组你熟悉的物质:
列的是一组你熟悉的物质:
①HCl ②CO2 ③H2O ④H2 ⑤NaOH ⑥Cl2
⑦NaF ⑧CH4 ⑨CaO ⑩MgCl2
(1)只含有共价键的是___ _____,只含有离子键的是________,既含离子键,又含有共价键的是________。
_____,只含有离子键的是________,既含离子键,又含有共价键的是________。
(2)属于共价化合物的是________,属于离子化合物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子能够大量共存的是 ( ) A.Mg2+、K+、SO42-、NO3- B.Ba2+、Mg2+、SO42+、Cl-
C.ClO-、K+、Na+、H+ D.H+、K+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关 说法中不正确的是 ( )。
说法中不正确的是 ( )。
A.由题目信息知:KMnO4的氧化性比MnO2的强
B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂
C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体
D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com