
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A.可与乙醇、乙酸反应,且反应类型相同
B.1 mo1分枝酸最多可与3 mol NaOH发生中和反应
C.分枝酸的分子式为C10H8O6
D.分枝酸分子中含有2种官能团
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.铜与氯气反应时,剧烈燃烧并产生蓝色的烟
B.次氯酸不如次氯酸盐稳定,故通常用次氯酸盐作为漂白剂和消毒剂的主要成分
C.生活中常用的“84”消毒液中的有效成分是NaCl
D.将金属钠投入硫酸铜溶液中可观察到的实验现象有气体生成,有红色的铜生成
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2  3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)= c(CH3C OO-)+ c(OH-)
OO-)+ c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式为:SiCl4(g)+2H2(g) Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A. 反应过程中,若将硅移出体系,能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min)
min)
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
下列物质的稀溶液中存在电离平衡的有(不考虑水的电离) ( )
A. NaHCO3 B. NaHSO4 C. NH4NO3 D. HBr
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:选择题
25℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
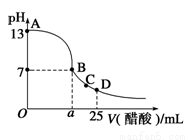
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.Ka(CH3COOH)=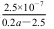
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
在一定温度下,固定体积为2L密闭容器中,发生反应:
2SO2(g)+O2(g)  2SO3(g ) ΔH <0,n(SO2)随时
2SO3(g ) ΔH <0,n(SO2)随时 间的变化如表:
间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min 内该反应的平均速率为0.005 mol/(L·min)
内该反应的平均速率为0.005 mol/(L·min)
C. 平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
D.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
已 知:4HCl(g)+O2 (g)
知:4HCl(g)+O2 (g)  2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键 | H-Cl | O=O | Cl-Cl | H-O |
E/ kJ·mol-1 | 431 | 497 | a | 465 |
其中a值为( )
A.242 B.303.5 C.180.5 D.365
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com