
【题目】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
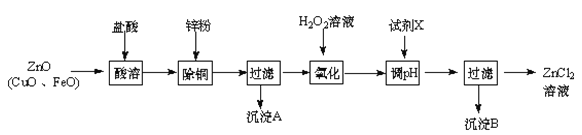
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。

(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X可以是 (选填序号:a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3 ;d.ZnSO4);pH应调整到 。
(3)氯化锌能催化乳酸(![]() )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 。
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
【答案】
(1)2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O
(2)abc ;3.2 ≤ pH<5.2(或:约为4)
(3)![]() ;
;![]() (或:
(或:![]() )
)
(4)O2 (或氧气); [Zn(OH)4]2-+2e-=Zn+4OH-
(5)氧化铜、氧化亚铁不溶于碱溶液中
【解析】
试题分析:炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,滤液中含有锌离子和亚铁离子,加过氧化氢氧化,把亚铁离子氧化为铁离子,加ZnO(或氢氧化锌等)调节PH,铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液。
(1)加过氧化氢将亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O;(2)调节pH时要消耗氢离子,但是不能引入杂质,ZnO、Zn(OH)2、Zn2(OH)2CO3均与氢离子反应生成锌离子,消耗氢离子的同时不引人杂质,ZnSO4不能与氢离子反应,所以不能调节pH,答案选abc;调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2;
(3)![]() 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为![]() ;
;![]() 分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:
分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:![]() ;
;
(4)石墨作电极电解时,阳极氢氧根离子失电子,阳极反应为:4OH--4e-═2H2O+O2↑,所以阳极产生的气体是O2;阴极上[Zn(OH)4]2-得电子生成Zn,则阴极的电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-。(5)ZnO能溶于强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分。用化学式或元素符号回答下列问题:
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________(填元素名称)。
(2)三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)在室温下有颜色的气体单质溶于水的离子方程式为_____ __;
(4)⑧与⑨分别与H2形成的氢化物的稳定性:__________,(用化学式表示)最高价氧化物对应的水溶液的酸性由强到弱的顺序:______ _________。(用化学式)
(5)①③⑤单质的活泼性顺序为_____>____>____(填元素符号),判断的实验依据是__(写出一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种前四周期的元素。A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态。C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8。E位于周期表第12纵列且是六种元素中原子序数最大的。R是由D、E形成的化合物,其晶胞结构如图所示。请回答下列问题:

(1)C元素的电负性___D元素的电负性(填“>”、“<”或“=”)。
(2)C的第一电离能比它同周期前一族相邻元素的第一电离能________
(填“大”或“小”)。
(3)E的价电子排布式为_______ _,该元素位于周期表中__ _族。
(4)化合物A2D的电子式为______________________。
(5)D和B形成的一种化合物D2B2广泛用于橡胶工业,它的分子结构与双氧水相似,但在该化合物分子中,所有原子最外层均满足8电子稳定结构。则D2B2分子中D原子的杂化类型是__________,D2B2是_________分子(填“极性”或“非极性”)。
(6)R的化学式为________________(用元素符号表示)。已知R晶体的密度为ρ g·cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。① ③ ② ④ ⑤ ⑥ n
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知: 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为80%
C.2min内A的平均反应速率为0.3 mol·(L·min)-1
D.若混合气体的密度不变,也不能明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 CO分析仪以燃料电池为工作原理,用来测量汽车尾气中的CO的含量,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是( )。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.为了有效的发展清洁能源,采用电解水的方法大量制备H2
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
II.浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。

(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。

(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g)![]() 4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用盐桥电池从某些含碘盐中提取碘的两个装置, 下列说法中正确的是
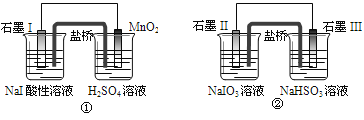
A.两个装置中石墨I和石墨II作负极
B.碘元素在装置①中被氧化,在装置②中被还原
C.①中MnO2的电极反应式为:MnO2+2H2O+2e-==Mn2++4OH
D.反应①、②中生成等量的I2时导线上通过的电子数之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构。B原子的最外层电子数是次外层的三倍,C、D单质都能跟水剧烈反应,1 mol D单质跟水反应产生11.2 L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子。试填写:
(1)用电子式表示A和C形成化合物的过程______________。
(2)C原子的结构示意图_______________,写出A、B两元素按1:1原子个数比形成化合物的电子式_______________。
(3)这4种元素的原子半径由大到小的顺序为_______________。(用元素符号表示)
(4)写出C单质与水反应的化学反应方程式__________________________;。
(5)写出D单质与水反应的离子方程式__________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com