
| 组别 | 起始浓度c/mol?dm3 | 平衡浓度c/mol?dm3 | K | 温度T | ||||
| H2 | N2 | NH3 | H2 | N2 | NH3 | |||
| 实验1 | 1.9868 | 1.356 | 0 | 1.35 | 1.15 | 0.412 | 5.98×10-2 | T1 |
| 实验2 | 0.6405 | 1.0435 | 0 | C1 | C2 | C3 | K2 | T1 |
| 实验3 | 0.6405 | 1.0435 | 0 | 0.51 | 1.00 | 0.087 | 6.05×10-2 | T2 |

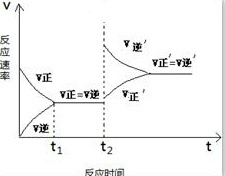 ,故答案为:逆;
,故答案为:逆; ;
;| 0.4122 |
| 1.353×1.15 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、63g?mol-1 |
| B、122g?mol-1 |
| C、126g?mol-1 |
| D、163g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| A、①④ | B、①② | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知 C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | ||
B、已知 C(s)+O2(g)=CO2(g)△H1 C(s)+
| ||
| C、已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则1mol氢气完全燃烧放出的热量为241.8kJ | ||
| D、已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含 20gNaOH 的稀溶液与稀盐酸完全中和,中和热为 28.65kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 | |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com