
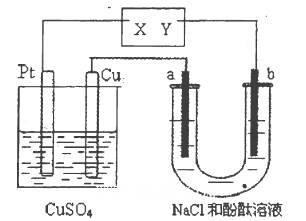
| A.X是正极,Y是负极 | B.X是负极,Y是正极 |
| C.CuSO4溶液的浓度逐渐减小 | D.CuSO4溶液的pH减小 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
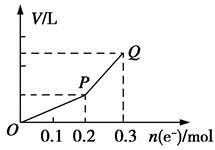
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
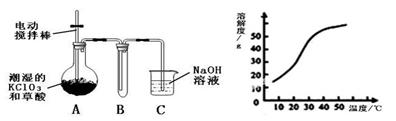
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X为C3H7COOH |
| B.电解的阳极反应式为C21H41COOH+X-2e-+2H2O=C23H46+CO32—+6H+ |
| C.电解过程中阴极区pH增大,Na+向阴极移动 |
| D.阴极的还原产物为H2和OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
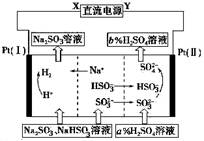
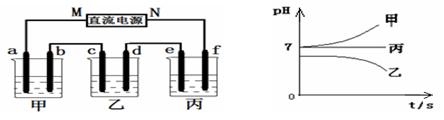
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
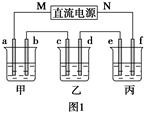
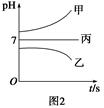
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电路中共转移0.9 mol电子 |
| B.阳极得到的气体中有O2,且其物质的量为0.35 mol |
| C.阴极的质量增加3.2 g |
| D.铝元素仅以Al(OH)3的形式存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下: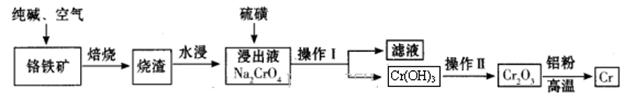
 Cr2O72-+H2O)。
Cr2O72-+H2O)。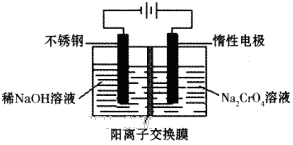
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com