
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② | | | |
| | | ⑦ | ⑧ |
(1)第三周期第ⅥA;(2分)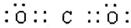 (1分)
(1分)
共价键(1分)H2CO3、H2SO4、HClO4;(1分)S2―>Cl―(1分)
(2)①4NH3+5O2 4NO+6H2O(2分)
4NO+6H2O(2分)
②3NO2+H2O=2HNO3+NO(2分)
(3) ①Cu2++2e―=Cu(2分)
②2Al+Fe2O3 2Fe+Al2O3(2分)
2Fe+Al2O3(2分)
解析试题分析:(1)②的原子序数不可能是1,由②在周期表中的位置可知,②处于第二周期,⑦⑧处于第三周期,②与⑦形成的液体化合物是常见的重要溶剂,该化合物为SC2或CCl4,由②⑦⑧的位置可知,②为碳,⑦为硫,⑧为氯,②与⑧形成的液体化合物为CCl4,S原子原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族;二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
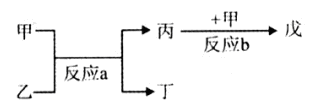
(2)戊为红棕色气体,则戊为NO2,反应b为NO+O2→NO2,由反应a可知,甲与乙反应生成丙,故甲为O2,故丙为NO,反应a为NH3+O2→NO+H2O,乙为NH3,丁为H2O,
①反应a的化学方程式为:4NH3+5O2 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
②NO2与H2O反应生成HNO3、NO,反应方程式为:3NO2+H2O=2HNO3+NO↑,故答案为:3NO2+H2O=2HNO3+NO↑;
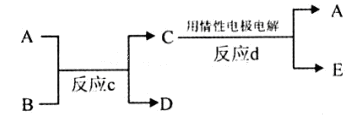
(3)①A是红色金属单质,A为Cu,E是具有黄绿色的气体,则E为Cl2,反应d中阴极发生还原反应,是铜离子放电生成Cu,反应d中阴极电极反应式为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②若反应c是在高温下进行的,物质C是一种两性化合物,为Al2O3,其中B是暗红色固体,为Fe2O3,反应c为铝热反应,A为Al、D为Fe、E为O2,反应c的方程式为:Fe2O3+2Al 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3.
2Fe+Al2O3.
考点:元素周期律和元素周期表的综合应用;无机物的推断


科目:高中化学 来源: 题型:填空题
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F、M为中学常见的氧化物,E是磁铁矿的主要成分(是黑色固体);H、K为中学常见的盐;M是一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)物质H的化学式为 。
(2)由F与M作用生成G的化学反应基本类型为 。
(3)A与C在加热条件下反应的化学方程式为: 。
(4)G的浓溶液在加热条件下能跟C反应,该反应中G体现了 (填序号)。
A.氧化性 B.还原性 C.漂白性 D.酸性
(5)若先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。Ks5u
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的 (已折算成标准状况)。甲与水反应也能产生
(已折算成标准状况)。甲与水反应也能产生 ,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到
,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到 和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
(1)甲的化学式是_________;乙的空间构型是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________ 有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之
_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生 ,判断理由是
,判断理由是
_______ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学常见物质,且含有一种相同的 元素,它们之间有如下转化关系,其中A是单质。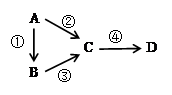
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式___________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。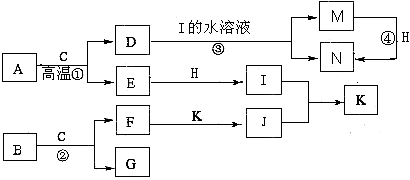
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN
C.浓氨水 D.酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系: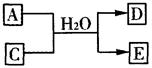
若E为白色沉淀,则E物质的化学式为 ;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n] (填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述和判正确、并且有因果关系的是
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com