
| A. | △H>0的反应,升高温度v正增大,v逆减小,平衡向正反应方向移动 | |
| B. | 若化学平衡移动了,但正、逆反应不一定都变化 | |
| C. | 正、逆反应速率都变化了,化学平衡必发生移动 | |
| D. | 石墨吸收能量后可转化为金刚石,说明金刚石比石墨稳定 |
分析 A.升高温度,正逆反应速率均增大,向吸热的方向移动;
B.加反应物浓度时,平衡发生移动,瞬间逆反应不变;
C.催化剂可加快反应速率,平衡不移动;
D.能量低的物质稳定.
解答 解:A.升高温度,正逆反应速率均增大,向吸热的方向移动,△H>0的反应,平衡正向移动,故A错误;
B.加反应物浓度时,平衡发生移动,瞬间逆反应不变,正反应速率瞬间增大,故B正确;
C.催化剂可加快反应速率,平衡不移动,对体积不变的反应,改变压强平衡不移动,故C错误;
D.能量低的物质稳定,由石墨吸收能量后可转化为金刚石,说明石墨比金刚石稳定,故D错误;
故选B.
点评 本题考查反应热与焓变、化学平衡移动的影响因素,为高频考点,把握温度和浓度对平衡影响、物质能量与稳定性的关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度 | |
| B. | 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3-+Ba2++2OH-?BaSO3↓+2H2O+SO32- | |
| C. | 滴加过程中,溶液中白色沉淀不断增加 | |
| D. | 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
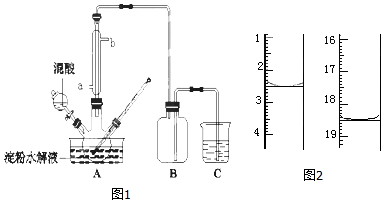
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
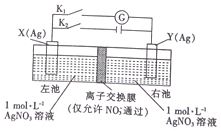
| A. | 闭合K2,断开Kl一段时间后,X电极质量增加 | |
| B. | 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大 | |
| C. | 断开K2,闭合K1,X 电极发生氧化反应 | |
| D. | 断开K2,闭合K1,NO3-从左池向右池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


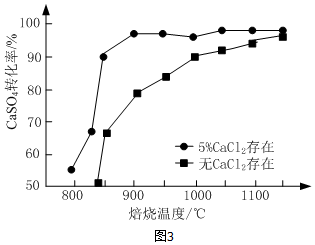
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com