
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 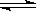 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
E.容器中气体密度不变 F.1mol H—H键断裂的同时断裂2 mol H-O键
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 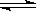 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
3min—4min达到平衡时CO的平衡浓度c3= (c3精确到小数点后面三位数),CO2 (g)的转化率= 。
【知识点】反应热 化学反应速率 平衡 F1 G5 G2
【答案解析】(1)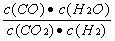
(2)放热 (3)B、C、F;
(4)c3 = 0.120mol/L (写0.12的给1分,即有效数字不对扣1分)
CO2 (g)的转化率: 60%
解析: ⑵根据表知升温,平衡常数减小,则正向是放热反应
⑵该反应是气体体积不变的反应,不能根据容器中压强不变判断平衡建立,c(CO2) = c(CO) 只是反应过程中可能出现的情况,不一定是平衡状态,由于容积固定,根据质量守恒知容器中气体密度始终不变,即不能表明平衡建立,根据反应知 1mol H—H键断裂的同时有2 mol H-O键形成,则当1mol H—H键断裂的同时断裂2 mol H-O键表明平衡建立,因此选B、C、F。
⑷ CO2(g) + H2(g) 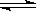 CO(g) + H2O(g)
CO(g) + H2O(g)
起始 0.2 0.3 0 0
平衡 c1=0.2- c3 c2=0.3- c3 c3 c3
变化 c3 c3 c3 c3, c32÷(0.2- c3)(0.3- c3)=K=1,c3= 0.120mol/L,二氧化碳的转化率=0.120×100%/0.2= 60%
【思路点拨】有关平衡的计算采取三段法。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
Ⅰ.分子式为C8H8O的F是高分子光阻剂生产中的主要原料。F具有如下特点:①能与FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有2种。
(1)F在一定条件下发生加聚反应的化学方程式为__________________。
(2)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中一种的结构简式________________。
Ⅱ.芳香族化合物E的分子式是C8H8Cl2。E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式是__________________。
Ⅲ.分子式C4H8O2的同分异构体中,能与NaHCO3溶液反应放出CO2的有________种,其相应的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液。则下列关于甲烷燃料电池的说法正确的是( )
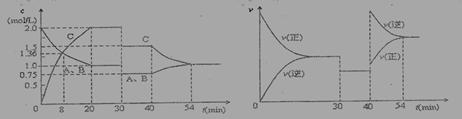
A.负极反应式为:CH4+10OH-—→CO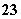 +7H2O+8e-
+7H2O+8e-
B.负极反应式为:O2+2H2O+4e-—→4OH-
C.随着反应进行,电解质溶液碱性不变
D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2===CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表面上镀有金属保护层的铁板,当镀层损坏使铁板裸露后,在相同条件下最耐腐蚀的是( )
A.镀锌铁板(白铁) B.镀锡铁板(马口铁)
C.镀银铁板 D.镀铜铁板
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入

生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe—→Fe2++2e-
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A、若a=b,则c(NH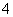 )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH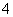 )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
按一定的分类方法可将浓硫酸、无水氯化钙、固体氢氧化钠等物质归于同一类物质。现有X物质亦可归于此类物质,但X与固体氢氧化钠有更多相似的性质。则X应该是( )
A.KOH溶液
B.无水硫酸铜
C.氧化钙
D.硝酸钾固体
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4: 。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 等玻璃仪器。
(2)步骤1发生反应的离子方程式为
过滤的目的是__________________________________________。
(3)当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH控制较难操作,可改用____________________,发生反应的离子方程式为 。
(5)步骤4的操作为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com