
在一定条件下,当单独改变可逆反应N2+3H2 2NH3(正反应为放热反应)的下列条件后,有关的叙述中错误的是( )
2NH3(正反应为放热反应)的下列条件后,有关的叙述中错误的是( )
A.加入催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.增大压强,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降低温度,v(正)、v(逆)都减小,且v(逆)减小的倍数大于v(正)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
科目:高中化学 来源: 题型:
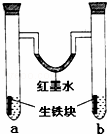
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
|
| A. | 红墨水柱两边的液面变化是左高右低 |
|
| B. | b试管中溶液pH值减小 |
|
| C. | 两试管中相同的电极反应式是:Fe﹣3e﹣=Fe3+ |
|
| D. | a试管中阳极反应式为:O2+2H2O﹣4e﹣=4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
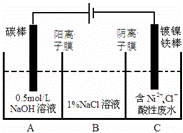
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
Ni2+(高浓度)>H+>Ni2+(低浓度)
|
| A. | 碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O |
|
| B. | 电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
|
| C. | 为了提高Ni的产率,电解过程中需要控制废水pH |
|
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应是铝的一个重要性质。某校化学兴趣小组同学,取磁性氧化铁在如图实验装置进行铝热反应,冷却后得到“铁块”混合物。

取反应后的“铁块”研碎取样称量,加入如图装置滴入足量NaOH溶液充分反应,测量生成气体体积。试回答下列问题:
① 该实验的实验目的是:测量样品中 的百分含量(填物质名称)。
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 。
③量气管在读数时调节左右管液面相平之前的步骤是________ _。
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用。如果装置使用分液漏斗,测量出的该物质百分含量将会 (填“偏大”或“偏小”)。
⑶ 另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是 。
③若最终红色粉未M的质量为12.0 g,则该“铁块”中铁的百分含量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用浓硫酸代替稀硫酸
②加热
③改用铝粉
④增大稀硫酸的体积
⑤加水
⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL
0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
解析下列事实的离子方程式不正确的是
A. 氨水使湿润的红色石蕊试纸变蓝:
B. 工业上用过量的溶液吸收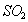 :
: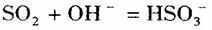
C. 用烧碱溶液清洗铝表面的氧化膜: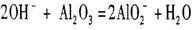
D. 用石灰乳吸收泄漏的氯气: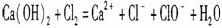
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0,反应吸热时,ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,ΔH为“-”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com