
【化学——选修2:化学与技术】(15分)
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 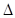 H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示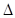 H,则
H,则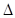 H= ;
H= ;
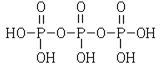
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;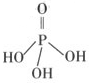
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
(1) △H1—3△H2+18△H3 (2分)
(2)  (2分) ,Na5P3O10(2分)
(2分) ,Na5P3O10(2分)
(3)①2Ni2+ + 1H2PO2-+ 1H2O →2Ni+ +1H2PO3-+ 2H+(3分)
②化学镀中镀件直接与电解质溶液接触反应;(2分)
电镀通过外加电流,在镀件外形成镀层;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应; (2分)
装置简便,节约能源,操作简便 (2分)
解析试题分析:(1)热化学方程式4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4可以将下列三个反应相加得到:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1;6Ca3(PO4)2(s)+30C(s)=3P4(g)+18CaO(s)+30CO(g)3△H2;18SiO2(s)+18CaO(s)=18CaSiO3(s)18△H3;根据盖斯定律可得△H=△H1+3△H2+18△H3。
(2)一个磷酸中的羟基与另一个磷酸的H之间可以脱水.结构式则为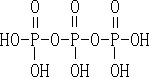 ;“五钠”即五个钠原子,所以三聚磷酸钠的化学式为Na5P3O10。
;“五钠”即五个钠原子,所以三聚磷酸钠的化学式为Na5P3O10。
(3)①(a)根据得失电子守恒:镍元素的化合价降低了1价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+2Ni2++H2PO2-+═2Ni++H2PO3-+2H+。
②从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,电镀通过外加电流,在镀件外形成镀层,化学镀是利用化学腐蚀反应,电镀是利用电解池,外加电流进行氧化还原反应;化学镀的优点为:装置简便,节约能源,操作简便,化学镀对镀件的导电性无特殊要求。
考点:本题考查盖斯定律、产物的判断、氧化还原反应原理及应用、电镀原理。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
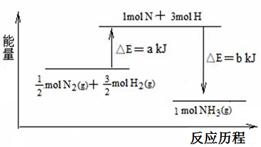
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: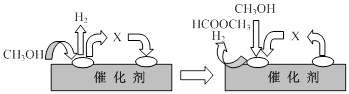
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。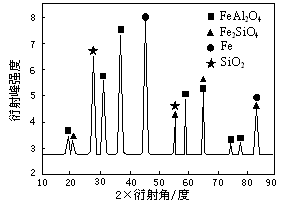
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。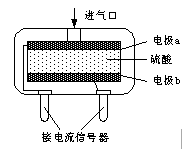
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1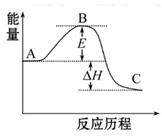
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示: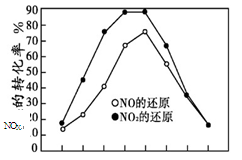
① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
 O2+Hb·CO K=220
O2+Hb·CO K=220查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。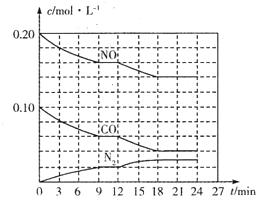
①CO在0-9min内的平均反应速率v(CO)=________mol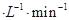 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(3分)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O激光TiO22H2↑+O2↑。制得的氢气可用于燃料电池。则太阳光分解海水时,实现了从太阳能转化为_______能,水分解时,断裂的化学键有________,断裂该键 能量。(填“吸收”或“放出”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是 。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5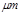 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
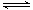 2NO(g) △H
2NO(g) △H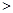 0
0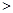 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com