
【题目】室温下,将尿酸钠(![]() )悬浊液静置,取上层清液,再通入
)悬浊液静置,取上层清液,再通入![]() ,溶液中尿酸的浓度
,溶液中尿酸的浓度![]() 与
与![]() 的关系如图所示。己知:
的关系如图所示。己知:![]() ,
,![]() ,下列说法正确的是
,下列说法正确的是
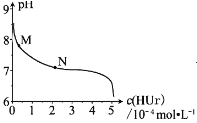
A. 上层清液中,![]()
B. 当![]() 时,
时,![]()
C. 在![]() 的变化过程中,c(Na+) ·c(Ur-)的值将逐渐减小
的变化过程中,c(Na+) ·c(Ur-)的值将逐渐减小
D. 当![]() 时,
时,![]()
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是________________。
a.反应速率 v(![]() )=v(
)=v(![]() )
)
b.容器内压强不再随时间而发生变化
c.容器内 ![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(![]() )∶n(
)∶n(![]() )∶n(
)∶n(![]() ) = 6∶4∶5∶6
) = 6∶4∶5∶6
e.12mol N-H键断裂的同时生成 5mol N≡N 键
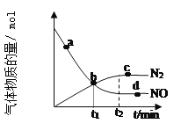
②某次实验中测得容器内 NO 及![]() 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
(填﹥、﹤或﹦)
(2)一定条件下,在 2L 密闭容器内,反应![]() ,n(
,n(![]() )随时间 变化如下表:
)随时间 变化如下表:
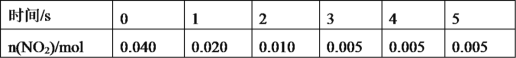
①用![]() 表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,
表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,![]() 的转化率为______。
的转化率为______。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
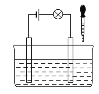
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.硫酸中逐滴加入氢氧化钡溶液
D.醋酸中逐滴加入氨水(一水合氨为弱电解质,CH3COONH4为强电解质)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
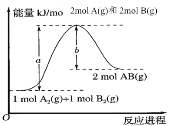
A.该反应需要在加热条件下才能进行
B.每生成2mol AB(g)吸收的热量为(a—b)kJ
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A—A键和1mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知二茂铁(Fe(C5H5)2)熔点是173 ℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5 -与Fe2+之间是以离子键相结合
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
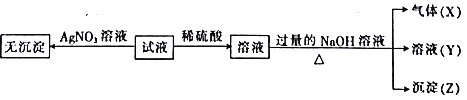
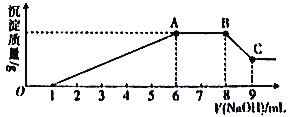
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种,沉淀Z的化学式____________。
(2)检验气体X的方法是______________________;
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________。
(4)A点对应的固体质量为__________g。
(5)通过实验I可以确定该溶液中一定存在的阴离子是_______________,推算该溶液中阴离子的浓度为_________mol L-l,检验该阴离子的方法是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是

A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com