
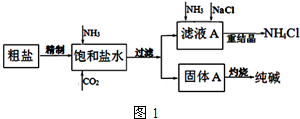
 纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.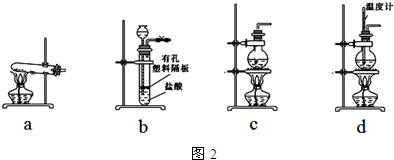
分析 (1)据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)NH3易溶于水,有利于吸收溶解度不大的CO2;根据溶解平衡,增加反应物的浓度有利于晶体析出;
(3)侯氏制碱法主要操作是在氨化饱和的NaCl溶液里通CO2,因此后续操作中得到的CO2和NaCl可循环利用;
(4)实验室制取二氧化碳的反应原理和条件;根据在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-加入碱或生石灰产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
(5)根据实验的原理:先称取一定量的天然碱晶体并溶解得到水溶液,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数.
解答 解:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,故答案为:a;c;d;e;b;
(2)NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2;通入NH3可通过与HCO3-的反应,增加NH4+深度,并利用精盐增大Cl-浓度,根据溶解平衡的移动,有利于NH4Cl结晶析出,
故答案为:NH3易溶于水,有利于吸收溶解度不大的CO2;NH3溶于水能将HCO3-转化为CO32-,并增大加入NH4+浓度;加入精盐增大Cl-浓度,有利于NH4Cl结晶析出;
(3)煅烧炉里生成的CO2可循环利用,滤液a析出晶体氯化铵后得到的NaCl溶液可循环利用,则 ,故答案为:
,故答案为: ;
;
(4)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体$\stackrel{不加热}{→}$气体;浓氨水中加碱或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-,加入碱平衡左移,同时放出大量的热促进氨水的挥发,制得氨气,故答案为:b;浓氨水;
(5)实验的原理:先称取样品质量并溶解,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数,所以将天然碱晶体样品,溶于适量蒸馏水中,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,然后过滤、洗涤、干燥、称量沉淀即可,
故答案为:①称取一定质量的天然碱晶体;②加入足量稀硫酸并微热、产生的气体通过足量Ba(OH)2溶液 ③过滤、洗涤、干燥、称量、恒重沉淀.
点评 本题以制碱原理制取Na2CO3,涉及到物质的除杂和提纯,常见的实验操作,物质的制备等,难度中等,培养了学生运用知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | ||
| C. | 2:1 | D. | 有一装置不消耗水,无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以氢氧燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 | |
| C. | 阳极反应CH3CHO-2e-+2H+═CH3COOH+H2O | |
| D. | 电解过程中,由于硫酸钠不参与电极反应,故阳极区始终c(Na+)=2 c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
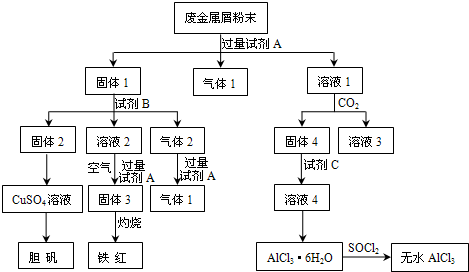
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )| A. | 甲为C、X为O2 | B. | 甲为Fe、X为Cl2 | C. | 甲为N2、X为O2 | D. | 甲为NaOH、X为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

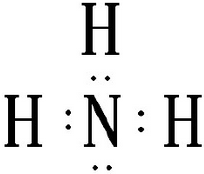 .向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
.向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com