
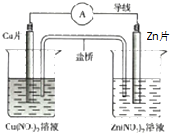
| A. | 盐桥中阴离子向正极移动 | |
| B. | 正极的电极反应是:Zn2++2e-═Zn | |
| C. | Zn片上发生氧化反应 | |
| D. | 用该电池电解水,析出3.2gCu时生成1.12LO2(标况下) |
分析 图为原电池装置,Zn为负极,发生氧化反应Zn-2e-═Zn2+,Cu为正极,发生还原反应Cu2++2e-═Cu,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电子守恒解答该题.
解答 解:A.盐桥中阴离子向负极移动,故A错误;
B.Cu为正极,溶液中的铜离子在正极上发生还原反应,正极的电极反应是:Cu2++2e-═Cu,故B错误;
C.Zn为负极,失电子发生氧化反应,故C正确,
D.3.2gCu的物质的量为0.05mol,转移电子为0.1mol,根据电子守恒可知,电解水生成氧气为0.1mol×$\frac{1}{4}$=0.025mol,在标准状况下体积为0.56L,故D错误;
故选:C.
点评 本题考查原电池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,注意把握原电池的工作原理和电子守恒在计算中的应用,学习中注意相关知识的积累.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
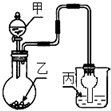 用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )| 选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
| A | CH3COOH | NaHCO3 | 苯酚钠 | 无明显现象 |
| B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
| C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
| D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是 +2NaOH→
+2NaOH→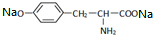 +2H2O.
+2H2O.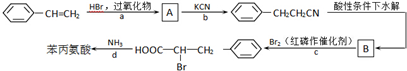
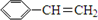 +HBr→
+HBr→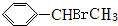 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$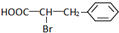 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
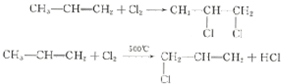
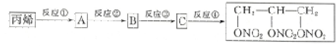
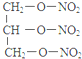 +3H2O.
+3H2O.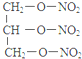 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.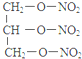 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
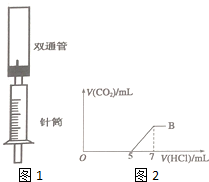 为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.
为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
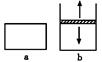
| A. | x的值为2 | |
| B. | B物质可为固体或液体 | |
| C. | 平衡时,a容器的体积小于V L | |
| D. | a、b容器中从起始到平衡所需时间相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
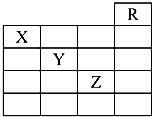 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com