
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备![]() 已知某化工厂的含镍催化剂主要含有Ni,还含有
已知某化工厂的含镍催化剂主要含有Ni,还含有![]() 、
、![]() 的单质及氧化物,其他不溶杂质
的单质及氧化物,其他不溶杂质![]() 。
。

部分阳离子以氢氧化物形式沉淀时的pH如表所示:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 加入
加入![]() 时发生反应的离子方程式______。
时发生反应的离子方程式______。
![]() 操作b为调节溶液的pH,你认为pH的调控范围是______。
操作b为调节溶液的pH,你认为pH的调控范围是______。
![]() 产品晶体中混有少量绿矾
产品晶体中混有少量绿矾![]() ,其原因可能是______
,其原因可能是______![]() 写出一点即可
写出一点即可![]() 。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用
。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用![]() 的酸性
的酸性![]() 标准液滴定,直到______为止,重复以上操作两次,消耗酸性
标准液滴定,直到______为止,重复以上操作两次,消耗酸性![]() 溶液体积的平均值为
溶液体积的平均值为![]() 不被氧化
不被氧化![]() ,则该产品晶体的纯度是______。
,则该产品晶体的纯度是______。![]() 结果保留3位有效数字
结果保留3位有效数字![]() 的摩尔质量为
的摩尔质量为![]()
![]() 可用于制备镍氢电池
可用于制备镍氢电池![]() ,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是
,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是![]() ,则NiMH电池放电过程中正极的电极反应式为______。
,则NiMH电池放电过程中正极的电极反应式为______。
【答案】![]()
![]()
![]() 的用量不足
的用量不足![]() 或
或![]() 失效
失效![]() 、保温时间不足导致
、保温时间不足导致![]() 未被完全氧化造成的 滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
未被完全氧化造成的 滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色 ![]()
![]()
【解析】
含镍催化剂主要含有Ni,还含有![]() 、
、![]() 的单质及氧化物,其他不溶杂质
的单质及氧化物,其他不溶杂质![]() 。碱浸后,过滤得到固体加入酸浸,过滤,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液
。碱浸后,过滤得到固体加入酸浸,过滤,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液![]() 防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到
防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到![]() 晶体,以此解答该题。
晶体,以此解答该题。
![]() 过氧化氢具有强氧化性,可与亚铁离子发生氧化还原反应,反应的离子方程式为
过氧化氢具有强氧化性,可与亚铁离子发生氧化还原反应,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 依据图表中沉淀需要的溶液PH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液PH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在
依据图表中沉淀需要的溶液PH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液PH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在![]() 间,故答案为:
间,故答案为:![]() ;
;
![]() 产品晶体中有时会混有少量绿矾
产品晶体中有时会混有少量绿矾![]() ,说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,用
,说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,用![]() 的酸性
的酸性![]() 标准液滴定,滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,说明达到滴定终点,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用
标准液滴定,滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,说明达到滴定终点,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用![]() 的酸性
的酸性![]() 标准液滴定,消耗酸性
标准液滴定,消耗酸性![]() 溶液体积的平均值为
溶液体积的平均值为![]() 不被氧化
不被氧化![]() ,则
,则![]() ,反应中Fe元素化合价由
,反应中Fe元素化合价由![]() 价升高到
价升高到![]() 价,Mn元素化合价由
价,Mn元素化合价由![]() 价降低到
价降低到![]() 价,则有关系式
价,则有关系式![]() ,可知样品中
,可知样品中![]() ,则该产品晶体的纯度是
,则该产品晶体的纯度是![]() ,故答案为:
,故答案为:![]() 的用量不足
的用量不足![]() 或
或![]() 失效
失效![]() 、保温时间不足导致
、保温时间不足导致![]() 未被完全氧化造成的;滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
未被完全氧化造成的;滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;![]() ;
;
![]() 电池放电过程中,正极上NiOOH得电子生成
电池放电过程中,正极上NiOOH得电子生成![]() ,则正极的电极方程式为:
,则正极的电极方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
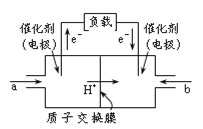
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )

A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B和D的物质的量浓度均为0.4molL﹣1
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
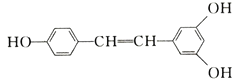
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种原色的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
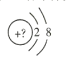
(1)若该微粒是电中性微粒,这种微粒的元素符号是_____________。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的 化学方程式为______________。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为_______________。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为_____________。
(5)若该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为![]() ,请回答下列问题.
,请回答下列问题.
(1)A中所含官能团的名称是_______、______;
(2)A可能发生的反应有______(填序号);
①取代反应 ②消去反应 ③水解反应 ④酯化反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在指定条件下电离方程式正确的是( )
A. Na2CO3溶于水:Na2CO3===Na22++CO32-
B. Al(OH)3酸式电离:Al(OH)3===AlO2-+H2O+H+
C. NaHS溶于水HS-的电离:HS-+H2O![]() H2S+OH-
H2S+OH-
D. NaHSO4加热熔化:NaHSO4===Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法错误的是
A. 12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B. 5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C. 92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA
D. 标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com