
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。
【答案】 第三周期IIA族 Mg3N2 + 6H2O=3 Mg(OH)2↓ + 2NH3↑ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 2F2+2H2O=4HF+O2↑ 置换 H2SiO3< H2CO3< HNO3 HF>HCl>HBr>HI Al(OH)3+3 H+== Al3+ + 3H2O
CaCl2+2NH3↑+2H2O 2F2+2H2O=4HF+O2↑ 置换 H2SiO3< H2CO3< HNO3 HF>HCl>HBr>HI Al(OH)3+3 H+== Al3+ + 3H2O
【解析】由元素在周期表的位置可知,①~⑧分别为H、C、N、F、Mg、Al、Si、S。(1)①-⑦元素中金属性最强的元素为Mg,位于周期表中的位置为第三周期IIA族;(2)③与⑤形成的化合物氮化镁溶于水会剧烈反应生成白色沉淀氢氧化镁和气体A即氨气,反应的化学方程式 为Mg3N2 + 6H2O=3 Mg(OH)2↓ + 2NH3↑,氨气的实验室制备化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;(3)④所形成的单质F2与水反应的方程式为2F2+2H2O=4HF+O2↑,该反应的类型是置换反应;(4)非金属性越强其最高价氧化物的水化物的酸性越强,故②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是H2SiO3< H2CO3< HNO3;④非金属性越强形成的氢化物越稳定,故所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是HF>HCl>HBr>HI;(5)表中元素③、⑥它们最高价氧化物的水化物硝酸和氢氧化铝相互反应的离子方程式为Al(OH)3+3 H+== Al3+ + 3H2O。
CaCl2+2NH3↑+2H2O;(3)④所形成的单质F2与水反应的方程式为2F2+2H2O=4HF+O2↑,该反应的类型是置换反应;(4)非金属性越强其最高价氧化物的水化物的酸性越强,故②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是H2SiO3< H2CO3< HNO3;④非金属性越强形成的氢化物越稳定,故所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是HF>HCl>HBr>HI;(5)表中元素③、⑥它们最高价氧化物的水化物硝酸和氢氧化铝相互反应的离子方程式为Al(OH)3+3 H+== Al3+ + 3H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. SiO2 既能和NaOH 溶液反应,又能和氢氟酸反应,所以SiO2属于两性氧化物
B. 因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C. CO2和SiO2都能与碳反应,且都作氧化剂
D. CO2和SiO2 都是酸性氧化物,所以两者物理性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2 , 反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)第①步反应的化学方程式为 。第②步反应的化学方程式为 。
(2)可循环使用的物质是 。工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
(3)检验CaO2·8H2O是否洗净的方法是 。
(4)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
(5)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。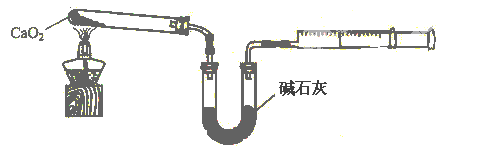
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d与氢形成的化合物中化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,则和铜反应的硝酸的物质的量可能是
A. 0.55mol B. 0.4mol C. 0.6mol D. 0.65mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥ .
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
① | 2 | 4 | 2 | 25 |
② | 3 | |||
③ | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.Na2O+H2O═2NaOH
C.2KI+Br2═2KBr+I2
D.MgO+2HCl═MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律.
用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.

(1)过氧化氢的电子式:_______________;
(2)从图1中选择氧气的制备装置______,反应前需要的操作是:________________;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示)_____________;
(4)你认为能证明Cl的非金属性强于S的是___________
a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com