
| A.破坏臭氧层 | B.高温下能使一些金属氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
科目:高中化学 来源:不详 题型:填空题
 + HNO2 → HN3(叠氮酸) + H2O (未配平);
+ HNO2 → HN3(叠氮酸) + H2O (未配平);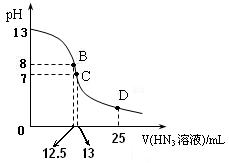
 D点时溶液中各离子的浓度由大到小的顺序为
D点时溶液中各离子的浓度由大到小的顺序为  (HN3
(HN3 ) =
) = 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑, (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ⑥ 色,有关反应的化学方程式是 ⑦ 。
⑥ 色,有关反应的化学方程式是 ⑦ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com