
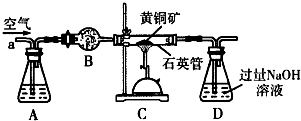

分析 将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品,为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,通过碱石灰干燥吸收水蒸气,进入装置C加热反应,反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),生成的二氧化硫气体进入装置D被过滤氢氧化钠溶液吸收得到亚硫酸钠溶液,
(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,通过碱石灰干燥吸收水蒸气,生成的二氧化硫能和氢氧化钠反应生成盐;
(2)亚硫酸根离子能被过氧化氢氧化生成硫酸根离子;洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数;
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是加入硫酸溶解后加入高锰酸钾溶液观察高锰酸钾溶液是否褪色设计检验方案;
(4)泡铜成分为Cu、Cu2O,Cu+在强酸性环境中会发生反应生成Cu和Cu2+.据此设计实验验证是否含有氧化亚铜.
解答 解:(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,锥形瓶A内所盛试剂是氢氧化钠溶液,通过碱石灰干燥吸收水蒸气,生成的二氧化硫能和过量氢氧化钠反应生成亚硫酸钠盐和水,反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:氢氧化钠,干燥气体,SO2+2OH-=SO32-+H2O;
(2)亚硫酸根离子具有还原性能被过氧化氢氧化生成硫酸根离子,反应的离子方程式为:H2O2+SO32-=SO42-+H2O,洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,具体操作为:固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2-3次,m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数=$\frac{\frac{{m}_{2}g}{233g/mol}×32g/mol}{{m}_{1}}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$×100%,
故答案为:H2O2+SO32-=SO42-+H2O;固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2-3次;$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是加入硫酸溶解后加入高锰酸钾溶液观察高锰酸钾溶液是否褪色设计检验方案,
故答案为:C;
(4)泡铜成分为Cu、Cu2O,Cu+在强酸性环境中会发生反应生成Cu和Cu2+.据此设计实验验证是否含有氧化亚铜,取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有,
故答案为:取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有.
点评 本题考查混合物的分离和提纯,主要是物质性质、实验基本操作和实验探究设计等知识点,关键是提取题中的信息,根据所学知识完成,题目难度中等.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ⅢA族的B和Al都能形成+3价的化合物 | |
| B. | ⅤA族的N和P都能形成-3价的化合物 | |
| C. | ⅠA族的Na和K都能形成+1价的化合物 | |
| D. | ⅦA族的F和Cl都能形成+7价的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
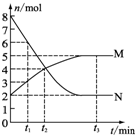 一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com