
【题目】一定温度和压强下,将等质量的CH4、CO2、O2、SO2四种气体分别吹入四个不同的气球,下列说法中正确的是( )

A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为___,此氢化物的还原性比元素⑨的氢化物__(强或弱),请用一个化学方程式证明这一事实___。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___,并比较其酸性的强弱__
(3)能生成两性氢氧化物的元素是___,其最高价氧化物的水化物电离方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为__。
(2)在第四周期所有元素中,基态原子未成对电子数最多的元素是__(填元素符号)。
(3)金属晶体热导率随温度升高会降低,其原因是__。
(4)铜的焰色反应呈___。在现代化学中,常用于区分晶体与非晶体的方法为___。
(5)Mn和Co的熔点较高的是___,原因___。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。

①钴晶胞堆积方式的名称为__;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为__pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活动小组同学用下图1装置进行实验,试回答下列问题。
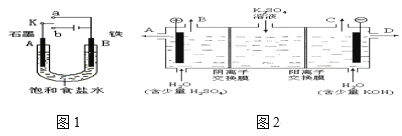
(1)若开始时开关K与a连接,则A极的电极反应式为____。
(2)若开始时开关K与b连接,则A极的电极反应式为____。
(3)当开关K与b连接时,关于这个实验,下列说法正确的是(填序号)____。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)___导出,制得的氧气从出口(填“A”、“B”、“C”、“D”)___导出。
②此时通过阴离子交换膜的离子数___(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
③通电开始后,阴极附近溶液pH会增大,请简述原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
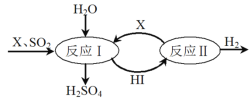
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0g铜与60.0mL一定浓度的硝酸发生如下反应:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。铜完全溶解产生的混合气体体积为8.96L(标况)。请计算(各数据保留两位有效数字):
(1)NO的体积为______
(2)该混合气体的平均摩尔质量约为______
(3)待产生的气体全部释放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
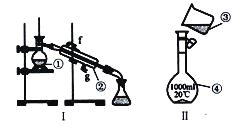
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_____。
(2)四种元素中第一电离最小的是____,电负性最大的是____。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
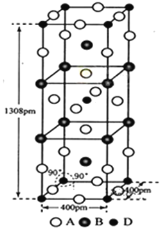
①该化合物的化学式为_____________;D的配位数为_______;
②列式计算该晶体的密度为___________g·cm-3。(列式并计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com