
分析 烷烃的通式CnH(2n+2),相对分子质量为14n+2,结合分子中C、H的关系解答该题.
解答 解:烷烃的通式为:CnH(2n+2),烷烃的相对分子量为:14n+2,
(1)某烷烃的相对分子质量为142,则14n+2=142,n=10,则分子式为C10H22,故答案为:C10H22;
(2)烷烃A在同温同压下蒸气的密度是H2的36倍,则相对分子质量为72,可知14n+2=72,n=5,分子式为C5H12,故答案为:C5H12;
(3)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L水蒸气,说明1mol烷烃生成15mol水,则H为30,分子式为C14H30,故答案为:C14H30.
点评 本题考查了有机物烷烃分子式的确定,为高频考点,题目难度中等,要求学生掌握物质的量与摩尔质量转化关系、同温同压下气体的摩尔质量与密度关系,难度不大.


科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z | W |
| 物质的量/mol | 1.00 | 2.00 | 0 | 2.00 |
| A. | 该可逆反应为反应前后气体体积恒定的反应 | |
| B. | 该可逆反应的正反应为放热反应 | |
| C. | 达到平衡前,反应向逆反应方向进行 | |
| D. | 升高温度,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
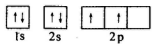 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
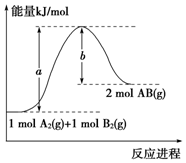
| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应过程的活化能为b kJ•mol-1 | |
| C. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| D. | 该反应的反应热△H=+(a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | CO2的水溶液能导电,所以CO2为电解质 | |
| C. | 可使用丁达尔效应来区分FeCl3溶液和Fe(OH)3胶体 | |
| D. | 1 mol 任何物质均含有约6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
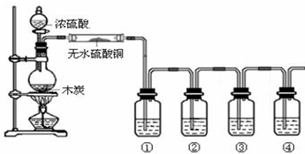
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
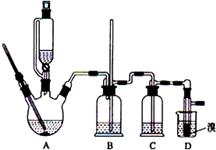 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红色发烟液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com